
 丙
丙| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
| 一定条件 |
| Ⅰ |
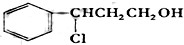
| O2/Cu |
| △ |
| 一定条件 |
| Ⅱ |
| Ⅰ.O3 |
| Ⅱ.Zn/H2O |
| Ⅰ.浓NaOH |
| Ⅱ.H+ |
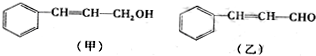
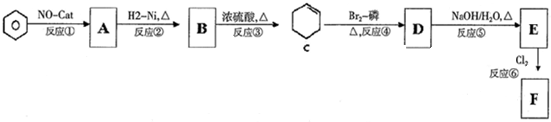
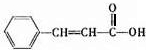 ,则C应为醇,因B为苯甲醛,则C为苯甲醇,E是相对分子质量为76,结合题给信息可知E应为OH-CH2-COOH,本身能发生缩聚反应生成F为
,则C应为醇,因B为苯甲醛,则C为苯甲醇,E是相对分子质量为76,结合题给信息可知E应为OH-CH2-COOH,本身能发生缩聚反应生成F为 ,以此解答该题.
,以此解答该题. ,
, .
.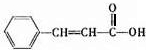 ,则C应为醇,因B为苯甲醛,则C为苯甲醇,E是相对分子质量为76,结合题给信息可知E应为OH-CH2-COOH,本身能发生缩聚反应生成F为
,则C应为醇,因B为苯甲醛,则C为苯甲醇,E是相对分子质量为76,结合题给信息可知E应为OH-CH2-COOH,本身能发生缩聚反应生成F为 ,
, ,故答案为:
,故答案为: ;
;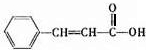 ,它的同分异构体,同时满足下列条件a.苯环上有两种类型的氢,说明苯环上对位有两个取代基,b. 能发生银镜反应,说明有醛基,这样的异构体结构简式有
,它的同分异构体,同时满足下列条件a.苯环上有两种类型的氢,说明苯环上对位有两个取代基,b. 能发生银镜反应,说明有醛基,这样的异构体结构简式有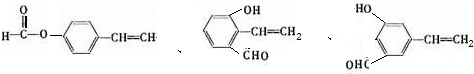 ,共3种,其中一种既能发生银镜反应说明有醛基,又能发生水解反应,说明是甲酸某酯,这样的结构简式为
,共3种,其中一种既能发生银镜反应说明有醛基,又能发生水解反应,说明是甲酸某酯,这样的结构简式为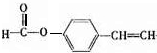 ,
, ;
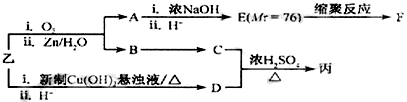
;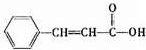 发生酯化反应生成丙,则丙为
发生酯化反应生成丙,则丙为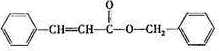 ,
,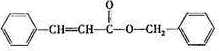 .
.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
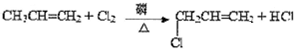
 已知:CH3CH2OH+NaBr+H2SO4(浓)
已知:CH3CH2OH+NaBr+H2SO4(浓)| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=8+n | ||
| B、m=10-n | ||
C、m=5-
| ||
| D、m=12-n |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 F的结构简式为
F的结构简式为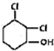
 直接制
直接制 ,理由是
,理由是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4mol、2mol、0mol、2mol |
| B、2mol、1mol、2mol、2mol |
| C、2mol、1mol、2mol、1mol |
| D、2mol、1mol、0mol、1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
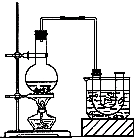
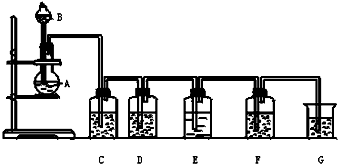 实验室用如图所示装置制备氯气(加热装置略去),并进行氯气性质实验,请回答下列问题:
实验室用如图所示装置制备氯气(加热装置略去),并进行氯气性质实验,请回答下列问题:| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量1mol/L稀盐酸于试管A中,加入少量MnO2,再加入 | |
| 步骤2:取少量1mol/L稀盐酸于试管B中,加入少量MnO2,再加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com