
 磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答: .
.分析 (1)用氯化磷(PH4Cl)和NaOH反应制取PH3的反应可以依据反应氯化铵和氢氧化钠反应生成氨气类推;
(2)PH3在空气中会自然得到P2O5,结合化学方程式定量关系计算消耗氧气物质的量;
(3)①组成氧硫化碳和磷化氢的原子为O、S、P、H,先判断电子层数,电子层数越多,原子半径越大;电子层数相同,再根据元素周期律,同周期元素的原子半径随着原子序数的增大而减小,主族元素周期数=电子层数,主族序数=最外层电子数;
②氧硫化碳是碳原子和硫原子、氧原子分别形成两个共价键,据此书写电子式;
③依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,依据电荷守恒和原子守恒书写离子反应方程式;
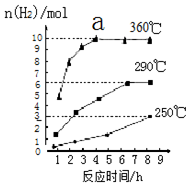
④根据图示反应时间与H2产量的关系,a点时M溶液中除S2O32-外,还有SO42-.
解答 解:(1)用氯化磷(PH4Cl)和NaOH反应为复分解反应生成PH3、氯化钠和水,制取PH3的化学方程式为:PH4 Cl+NaOH═PH3↑+NaCl+H2O,
故答案为:PH4 Cl+NaOH═PH3↑+NaCl+H2O;
(2)PH3在空气中会自然得到P2O5,反应的化学方程式为:2PH3+4O2=P2O5+3H2O,0.2molPH3会消耗O2物质的量0.4mol,
故答案为:0.4;
(3)①组成氧硫化碳和磷化氢的原子为O、S、P、H,氢元素有1个电子层,氧元素有2个电子层,磷、硫有3个电子层,所以磷、硫的原子半径大于氢、氧的原子半径,磷、硫是同周期元素,硫的原子序数大于磷的原子序数,由元素周期律知,磷的原子半径大于硫的原子半径,磷最外层为5个电子,处于第三周期第VA族,
故答案为:第三周期第VA族;
②羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为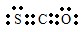 ,
,
故答案为: ;
;
③依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,
故答案为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-;
④反应Ⅲ中,a点360℃时,随着时间推移,氢气的量不变,Na2S初始含量为3mmol,若只发生:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,生成氢气:3mmol×$\frac{4}{2}$=6mmol,图中为9mmol,说明M溶液中除S2O32-外,还有SO42-,反应为:S2-+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$SO42-+4H2↑,
故答案为:SO42-.
点评 本题考查了物质性质、原子半径大小的比较、电子式和离子反应方程式的书写等,注意电子层结构相同的离子半径大小的比较方法.注意图象变化的同种分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
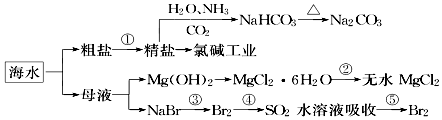 海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )| A. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 制取NaHCO3的反应是利用其溶解度相对较小 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
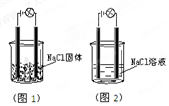 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | B. | NaCl溶液是电解质 | ||
| C. | NaCl在水溶液中离子键发生断裂 | D. | NaCl溶液中水电离出大量的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物:水玻璃、碱石灰、明矾 | B. | 酸:稀硫酸、次氯酸、硫酸氢钠 | ||
| C. | 酸性氧化物:SO2、CO2、SiO2 | D. | 碱性氧化物:CaO、Na2O2、K2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 悬浊液 | B. | 饱和溶液 | ||
| C. | 质量分数约为50%的溶液 | D. | 物质的量浓度为10mol/L的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com