
| A、HA较强 | B、HB较强 |
| C、两者一样 | D、无法比较 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、含有大量Fe3+的溶液中:NH4+、Na+、Cl-、CO32- |
| B、在强碱溶液中:Na+、K+、AlO2-、CO32- |
| C、在NH4+的溶液中:SiO32-、K+、SO42-、NO3- |
| D、在HCO3-的溶液中:K+、Na+、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减小压强 |
| B、缩小体积 |
| C、降低温度 |
| D、增大H2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、H+、SO42-、OH- |
| B、Na+、K+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、Cu2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
| B、可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| C、石油分馏、煤的气化、海水晒盐、花生中提取花生油等过程都是物理变化 |
| D、黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
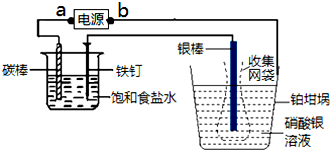
| A、a为电源的负极,铂坩埚为阳极 |
| B、称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0 mg,则电解过程中通过电解池的电量为96500C |
| C、实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏高 |
| D、铁钉和碳棒上都有气泡产生,若加入酚酞试剂,先在碳棒附近溶液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
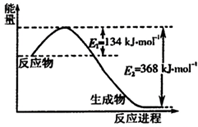 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com