
(16分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。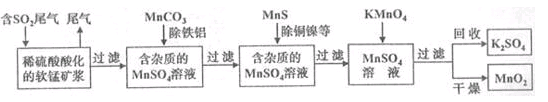
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
_ _。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是______。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2___________kg。
(1)A、C (2)消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀
(3)MnO2(s)+SO2(g) =MnSO4(s) △H=-248kJ/mol
(4)Mn2++2H2O-2e-=MnO2+4H+ (5)MnO2+H2O+e-=MnO(OH)+OH-
(6)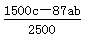
解析试题分析:(1)白色污染主要是塑料等难降解的物质形成的,SO2能形成酸雨,因此脱硫实现了废弃物的综合利用,同时也减少了酸雨形成,即答案选AC。
(2)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解生成氢氧化物沉淀。
(3)已知:热化学方程式①Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol,②S(s)+O2(g)=SO2(g)
△H=-297kJ/mol,③Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol,则根据盖斯定律可知③-(①+③)即得到SO2与MnO2反应生成无水MnSO4的热化学方程式MnO2(s)+SO2(g) =MnSO4(s) △H=-248kJ/mol。
(4)电解池中阳极失去电子发生氧化反应,则用惰性电极电解MnSO4溶液可制得MnO2,因此阳极是锰离子放电,其阳极电极反应式是Mn2++2H2O-2e-=MnO2+4H+。
(5)原电池中负极失去电子,正极得到电子,因此碱性锌锰电池放电时,正极是二氧化锰得到电子,则电极反应式是MnO2+H2O+e-=MnO(OH)+OH-。
(6)实际参加反应的SO2的物质的量是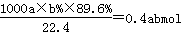 ,根据方程式MnO2(s)+SO2(g) =MnSO4(s)可知生成硫酸镁的物质的量是0.4abmol。最终生成二氧化锰是c kg,则根据方程式3MnSO4+2KMnO4+2H2O=5MnO2+K2SO4+2H2SO4可知,因此消耗硫酸锰的物质的量是
,根据方程式MnO2(s)+SO2(g) =MnSO4(s)可知生成硫酸镁的物质的量是0.4abmol。最终生成二氧化锰是c kg,则根据方程式3MnSO4+2KMnO4+2H2O=5MnO2+K2SO4+2H2SO4可知,因此消耗硫酸锰的物质的量是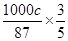 mol,则除去铁、铝、铜、镍等杂质时,所引入的锰元素的物质的量是
mol,则除去铁、铝、铜、镍等杂质时,所引入的锰元素的物质的量是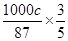 mol-0.4abmol,相当于二氧化锰的质量是(
mol-0.4abmol,相当于二氧化锰的质量是(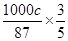 mol-0.4abmol)×87g/mol=(600c-34.8ab)g=
mol-0.4abmol)×87g/mol=(600c-34.8ab)g=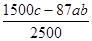 kg
kg
考点:考查物质制备工艺流程的有关判断与计算


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:单选题
下列反应既是氧化还原反应,又是吸热反应的是
| A.Ba(OH)2·8H2O与NH4Cl的反应 |
| B.铝片与稀硫酸反应 |
| C.甲烷在空气中燃烧 |
| D.灼热的焦炭与CO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)能源是影响经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是一种最理想的清洁能源。试填写下列空格。
(1)点燃氢气时,化学能主要转化为 ;
(2)氢气在原电池中反应时,化学能主要转化为 ;
(3)若在常温常压下,上述两种方式都反应1molH2,则放出的能量 (填“相同”或“不相同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分) 1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体表面合成氨的反应过程,示意如下图: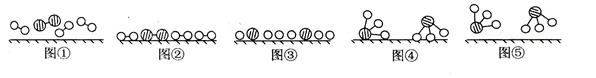
(1)图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______,______。
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g); ΔH= - 1266.8 kJ/mol
N2(g) + O2(g) =" 2NO(g)" ; ΔH =" +" 180.5kJ/mol, 氨催化氧化的热化学方程式为__________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
①当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为____________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将__________(填“正向”、“逆向”或“不”)移动。
②向A、B两容器中均通入xmolN2和ymolH2,初始A、B容积相同,并保持温度不变。若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题(H2O相对分子质量为18):
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 _ __570 kJ(填“>”、“<”或“=”)。
(2)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4 完全燃烧生成CO2气体和H2O(l)的热化学方程式为 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。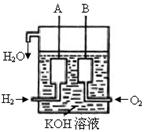
该电池的正极为:______(填A或B)。电极反应式为 ________ ____ 。
(4)若将上述装置中通入H2的改成CH4气体,也可以组成一个原电池装置,电池的总反应为:CH4+2O2+2KOH = K2CO3+3H2O ,则该电池的负极反应式为:______ _ _ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(18分)MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程如下图所示:
(1)操作I用到硅酸盐材质的仪器有烧杯、玻璃棒和_______ _____(填仪器名称)。
(2)稀硫酸浸泡时反应的离子方程式为_______________________________________;该反应中若析出19.2g单质A,共转移____________mo1电子。浸泡时反应速率较慢,下列措施不能提高浸泡时反应速率的是________(填代号)。
a.将矿石粉碎
b.提高浸泡温度
c.适当增大硫酸浓度
d.改变软锰矿与闪锌矿的比例
(3)由硫酸锰溶液可得到固体碳酸锰,然后在空气中煅烧碳酸锰制备MnO2。已知: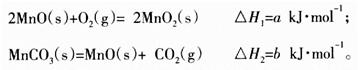
写出碳酸锰在空气中煅烧生成MnO2的热化学方程式_________________________。
(4)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示:
①a应与直流电源的_________(填“正”或“负”)极相连。.
②电解过程中氢离子的作用是______________和_____________;若转移的电子数为 个,左室溶液中
个,左室溶液中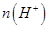 的变化量为________________。
的变化量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(共14分)甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |
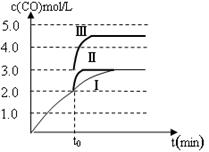
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分) 氨气是一种重要的化工原料,工业上用N2和H2合成NH3。现已知N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量变化示意图如下左图。回答下列问题: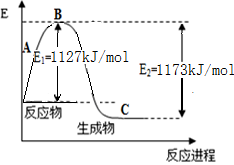
(1)该反应为 (填“吸热”或“放热”)反应。
(2)合成氨的热化学方程式为 。
(3)若又已知键能数据如上表,结合以上数据求出N-H键键能为 kJ/mol。
(4)工业上,以氨气为原料生产硝酸的第一步为氨催化氧化,请写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知下列热化学方程式:
①H2(g)+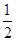 O2(g)=H2O(l)ΔH=-285.8 kJ/mol
O2(g)=H2O(l)ΔH=-285.8 kJ/mol
②H2(g)+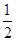 O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+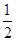 O2(g)=CO(g)ΔH=-110.5 kJ/mol
O2(g)=CO(g)ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 。
(2)H2的燃烧热为 ,C的燃烧热为 。
(3)燃烧10 g H2生成液态水,放出的热量为 。
(4)CO的燃烧热为 ,其热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com