
【题目】如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是( ) 
A.只有在t1℃时,NaCl和MgSO4的溶解度才相等
B.t1℃~t2℃,MgSO4的溶解度随温度升高而减小
C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出
【答案】C
【解析】解:A、根据两物质的溶解度曲线不难看出,两物质的溶解度曲线有两个交点,即t1℃和t2℃时,两物质的溶解度相等,故A错误; B、由硫酸镁的溶解度曲线可知,在t1℃~t2℃时,硫酸镁的溶解度随温度的升高而增大,故B错误;
C、在t2℃时,硫酸镁的溶解度处于最大值,所以硫酸镁饱和溶液中溶质的质量分数大,故C正确;
D、由于在t2﹣t3℃,硫酸镁的溶解度随温度的增大而降低,因此把MgSO4饱和溶液的温度从t3℃降至t2℃时,溶液会由饱和溶液变成不饱和溶液,而不会有晶体析出,故D错误;
故选C.
【考点精析】根据题目的已知条件,利用溶解度、饱和溶液的概念的相关知识可以得到问题的答案,需要掌握在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫作这种溶质的饱和溶液;还能继续溶解某种溶质的溶液,叫作不饱和溶液;在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫作这种物质在这种物质在这种溶剂里的溶解度.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是中学常见的四种元素,原子序数依次增大。X的原子最外层电子数是次外层的2倍,Y 的氧化物属于两性氧化物,Y、Z 位于同周期,X、Y、Z的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)X在元素周期表中的位置是_________________。
(2)下列事实能用元素周期律解释的是_____________________________________(填字母序号)。
A.Y 的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.Z的气态氢化物的稳定性小于HF
C.WZ3的溶液可用于刻蚀铜制的印刷电路板
(3)Z的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因是______________________。
(4)工业上用电解法制备Y单质,化学方程式为___________________________。
(5)家用“管道通”的有效成分是烧碱和Y 的单质,使用时需加入一定量的水,此时发生反应的化学方程式为______________________________。
(6)W的单质可用于处理酸性废水中的NO3-,使其转化成为铵根离子,同时生成磁性的W的氧化物H,再进行后续处理。相应离子方程式为____________。Y 的单质与H在高温下反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等。下列说法中正确的是( )
![]()
A. Y元素的最高价氧化物对应的水化物的化学式为H3YO4
B. Y的最简单气态氢化物的水溶液显弱碱性
C. 原子半径由小到大的顺序为X<Z<Y<W
D. X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由法国、美国、荷兰的三位科学家获得,表彰他们在“分子机器的设计与合成”做出的贡献。下列物质由分子构成且属于电解质的是
A.H2SO4 B.NaCl C.NH3 D.Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:
MnO2 + FeS + H2SO4![]() MnSO4 + Fe2(SO4)3 + S + H2O
MnSO4 + Fe2(SO4)3 + S + H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按以下的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn。
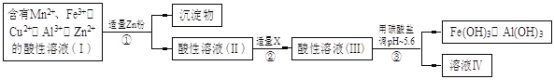
a.操作①中加Zn粉后发生反应的离子方程式为 。
b.操作②中加入适量X的作用是什么 ;X的首选物的化学式是 。
c.操作③中所加碳酸盐的化学式是 。
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程图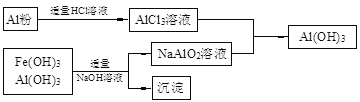
a.AlCl3溶液和NaAlO2溶液反应生成AI(OH)3的离子方程式为 ,若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为 、 。
b.若使用下列流程回收处理,请比较两个流程消耗酸碱的用量?
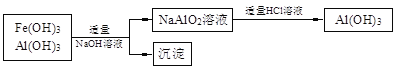
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是燃烧和代谢的最终产物,也是造成温室效应的废气,但CO2作为一种资源,开发和利用的前景十分诱人。

I、利用太阳能,以CO2为原料制取炭黑的流程如上图所示。过程2的化学方程式为:__________。
II、近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应制取甲醇。其工艺流程如图所示:
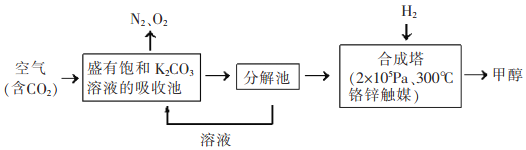
(1)①由吸收池导入分解池中的主要物质的化学式是____________。
②上述流程中____________(填化学式)可循环使用,该流程体现了“绿色化学”理念。
(2)不同温度下,在1L恒容密闭容器中充入2mol CO2和5 mol H2,相同时间内测得CO2的转化率随温度变化如下图所示:
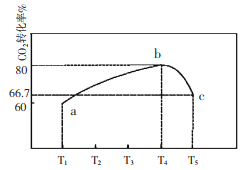
①合成塔中发生的化学反应方程式为____________。
②T1时a点v(正)____________v(逆)(填“>”,“<”,“=”)
③计算温度为T4时b的平衡常数为____________。
(3)为检验吸收池中饱和K2CO3溶液是否充足,量取l00mL吸收液用0.10 mol./L盐酸滴定,生成的V(CO2)(标准状况下)随V(盐酸)变化关系如图所示:
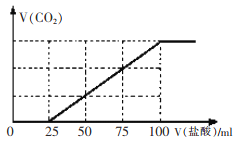
则该l00mL吸收液还可吸收标准状况下_______mLCO2.
III、以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将CO2转化为低碳烯烃,工作原理如右图所示。
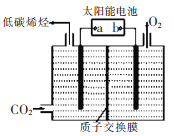
(1)H+的移动方向是_______________(填从左至右或从右至左);
(2)产生乙烯的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6。其流程如下:
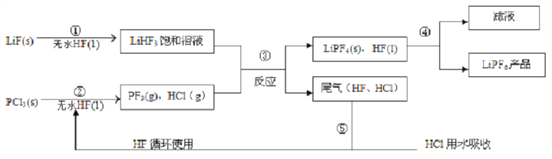
已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是________、__________。反应设备不能用玻璃材质的原因是______________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的____________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:________________。
(3)第④步分离采用的方法是_____________;第⑤步分离尾气中HF、HC1采用的方法是____________。
(4)LiPF6产品中通常混有少量LiF。取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为__________mol(用含有w、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
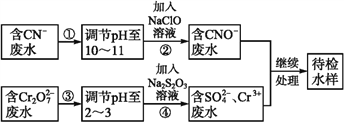
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______________。
(2)步骤④的反应为S2+Cr2O72-+H+![]() SO42-+Cr3++H2O(未配平), 则每消耗0.4 molCr2O72-转移转移____mol e-。
SO42-+Cr3++H2O(未配平), 则每消耗0.4 molCr2O72-转移转移____mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示HCN的电离常数Ka=____。若25 ℃时将浓度均为0.1 mol·L-1的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是____(填字母)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-)
b.此溶液一定有c(Na+)=c(HCN)+c(CN-)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)除去废水中的阳离子:取水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入一定量的Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式为_______、___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com