
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
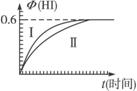
(1)达平衡时,I2(g)的物质的量浓度为______________mol·L-1。
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线(Ⅰ)所示,则该条件可能是_________________(填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的关系为______________(用一个含a、b、c的代数式表示)。
(4)室温时将0.01 mol HI气体溶于水配成100 ml 溶液,则该溶液中由水电离产生的氢离子的物质的量浓度为____________mol·L-1;若降低温度该溶液的pH将____________(填增大、减小或不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将0.01 mol NH4Cl和 0.002 mol NaOH 溶于水配成1 L 混合溶液,
!)该溶液中存在的三个平衡体系是:______________________________、
_______________________________、_______________________________。
溶液中共有_______种不同的粒子。
这些粒子中浓度为0.01 mol/L 的是_________,浓度为0.002 mol/L 的是_________。
(4)物质的量之和为0.01 mol的两种粒子是:___________和______________。
(5)_______和_______ 两种离子数量之和比OH-多0.008mol。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高二上学期期末考试化学试卷(解析版) 题型:填空题
(1) 在一定温度下,测得0.1 mol·L-1CH3COOH溶液的PH为3.0。则CH3COOH在水中的电离为 ,此温度CH3COOH的电离平衡常数为 。
(2) 在25℃时,Kw=1.0×10-14,测得0.1 mol·L-1 Na2A溶液的pH=7。则H2A在水溶液中的电离方程式为 ,该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH= 。
(3) 已知HCN(aq)+NaOH(aq)=NaCN(aq)+ H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq) +NaOH(aq)=NaCl(aq) + H2O(l) ΔH=-57.3 kJ·mol-1。
则在水溶液中HCN H++CN-电离的ΔH为
kJ·mol-1
H++CN-电离的ΔH为
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013届江苏省扬州市邗江区高二下学期期中考试化学试卷(解析版) 题型:填空题
(16分)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1L溶液。
①溶液中浓度为0.01 mol·L-1的离子是 。
②物质的量之和为0.01 mol的两种粒子是 和 。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 (填“碱性”、“酸性”或“中性”) ,醋酸体积 氢氧化钠溶液体积(填“>”、“<”或“=”)。
(3)将m mol·L-1的醋酸和n mol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7, m与n的大小关系是m n。(填“>”、“<”或“=”)
(4)浓度为0.100 mol·L-1的下列各物质的溶液中,c( )由大到小的顺序是
)由大到小的顺序是
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
(5)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H++HA-
HA- H++A2-
H++A2-
已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度
0.11 mol·L-1(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年陕西省高三上学期摸底考试化学试卷 题型:填空题
常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1L溶液,
(1)该溶液中存在的___________个平衡体系;
(2)溶液中共有___________种不同的粒子;
(3)这些粒子中浓度为0.01 mol·L-1的是____________ ,浓度为0.002 mol·L-1的是______________;
(4)物质的量之和为0.01 mol 的两种粒子是____________________;
(5)_________和__________两种粒子数量之和比OH-多0.008 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com