
 ��
������ ��A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������A��һ��ͬλ��ԭ�������ӣ�AΪHԪ�أ�BԪ���γɵĻ�����������࣬BΪCԪ�أ�CԪ�ص�����������Ӧˮ�������⻯���ܷ�Ӧ�����Σ�CΪNԪ�أ�DԪ��ԭ�ӵ������������Ӳ�����3����DΪO��A��Eͬ���壬EΪ��Ԫ�أ�
��� �⣺��A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������A��һ��ͬλ��ԭ�������ӣ�AΪHԪ�أ�BԪ���γɵĻ�����������࣬BΪCԪ�أ�CԪ�ص�����������Ӧˮ�������⻯���ܷ�Ӧ�����Σ�CΪNԪ�أ�DԪ��ԭ�ӵ������������Ӳ�����3����DΪO��A��Eͬ���壬EΪ��Ԫ�أ�
��1��CԪ�ص�����������Ӧˮ�������⻯���ܷ�Ӧ�����Σ�CΪNԪ�أ�NԪ�������ڱ��еĵڶ����ڵ�VA���壻
�ʴ�Ϊ���ڶ����ڵ�VA���壻
��2���������������Ӿ�����ͬ��������Ų���������11�����ӣ�������8�����ӣ��������Ӱ뾶��O2-��Na+��
�ʴ�Ϊ��O2-��Na+��
��3��Ԫ��A��C���γ�ԭ�Ӹ�����Ϊ2��1�ķ��ӣ�ΪN2H4���ǵ�ԭ�Ӻ͵�ԭ���γ�һ�����ۼ���ʣ��ۼ�����ԭ���γɹ��ۼ�������ʽΪ
�ʴ�Ϊ��
��4��CԪ�ص�����������Ӧˮ���������⻯�����ɵ���Ϊ����泥������Ϊǿ�������Σ�ˮ�������ԣ����ӷ���ʽ��NH4++H2O?NH3•H2O+H+��
�ʴ�Ϊ��NH4++H2O?NH3•H2O+H+��
��5��A��Ԫ�طǽ�����ǿ������̬�⻯��ķе��أ���A��ѡ��
B��̼�����γɹ��ۻ�������Ը��ۣ�˵�����õ��Ӷ�ƫ��������ԭ�ӵõ�������ǿ����Bѡ��
C����̬�⻯��Խ�ȶ���Ԫ�طǽ�����Խǿ����Cѡ��
D��������ۺ����ᣬ��D��ѡ��
��ѡ��BC��
��6��a��b��c��dԪ�طֱ�Ϊ��H��C��N��O��ԭ�Ӹ�����Ϊ5��1��1��3�Ļ�����ΪNH4HCO3��
NH4HCO3���������Ʒ�Ӧ����̼���ư�����ˮ����Ӧ�����ӷ���ʽΪ��NH4++HCO3-+2OH-=CO32-+NH3•H2O+H2O��
�ʴ�Ϊ��NH4++HCO3-+2OH-=CO32-+NH3•H2O+H2O��
��7���ٵ�����������Ӧ����һ��������һ��������������Ӧ���ɶ�������������������ˮ��Ӧ�������ᣬ��������Ϊǿ�ᣬ������NO��
�ʴ�Ϊ��NO��
���������������·�Ӧ���������ƣ��������������������ɹ������ƣ�����������ˮ��Ӧ�����������ƺ����������ӷ���ʽ��2Na2O2+2H2O=4Na++4OH-+O2����
�ʴ�Ϊ��2Na2O2+2H2O=4Na++4OH-+O2����
���� ���⿼��λ�ýṹ���ʵ�Ӧ�ã��漰���û�ѧ���Ԫ�ػ��������ʡ����ӷ���ʽ����д�ȣ���ȷԪ�ص�λ���ƶϳ���Ԫ���ǽ��Ĺؼ�����ϤԪ�ص����ʼ�����������ʼ��ɽ����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
| ʵ����� | �� | �� | �� |
| �Ͻ�����/mg | 255 | 385 | 459 |
| �����������/mL | 280 | 336 | 336 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��100 mL | B�� | ����100 mL | C�� | ����100 mL | D�� | ����100/�� mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
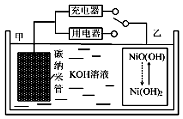 2016��8�£����Ϲ������ƻ������й��������⾭��ʾ�����С��ڽ�������仧����������H2��̼���ܵȲ��������Ķ��ε�ص�ԭ����ͼ��ʾ������˵����ȷ���ǣ�������
2016��8�£����Ϲ������ƻ������й��������⾭��ʾ�����С��ڽ�������仧����������H2��̼���ܵȲ��������Ķ��ε�ص�ԭ����ͼ��ʾ������˵����ȷ���ǣ�������| A�� | �ŵ�ʱ���缫��ӦΪ��NiO��OH��+H2O+e?�TNi��OH��2+OH? | |
| B�� | �ŵ�ʱ���缫Ϊ������OH?�����ҵ缫 | |
| C�� | ����ܷ�ӦΪH2+2NiO��OH��$?_{�ŵ�}^{���}$ 2Ni��OH��2 | |
| D�� | ���ʱ����ص�̼�缫��ֱ����Դ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
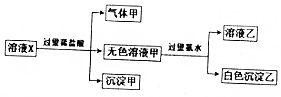 ˮ��Һ��ֻ������K+��Mg2+��AlO2-��Al3+��SiO32-��CO32-��SO42-�е����������ӣ�ijͬѧ����Һ����������ʵ�飺�����жϴ�����ǣ�������
ˮ��Һ��ֻ������K+��Mg2+��AlO2-��Al3+��SiO32-��CO32-��SO42-�е����������ӣ�ijͬѧ����Һ����������ʵ�飺�����жϴ�����ǣ�������| A�� | ��ҺX���ܺ���Mg2+��Al3+ | |
| B�� | ������ֻ�����ǹ������ | |
| C�� | ����������ɣ�������ҺX��һ������CO32- | |
| D�� | ����ȷ��SO42-�Ƿ��������ҺX�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com