
【题目】氯酸钾是常见的氧化剂,用于制造火药、烟火。工业上用石灰乳氯化法制备氯酸钾的流程如图所示:
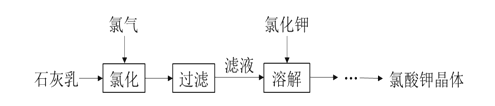
已知:氯化过程主要发生反应:![]()
完成下列填空:
(1)工业生产氯气的方法是________(请用文字表述)。
(2)氯化过程需要控制较高温度,其目的有:①_______;②减少Cl2与Ca(OH)2之间的副反应。
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应的化学方程式:______。得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是_______。
(4)为测定所得晶体中氯酸钾的纯度,将a g样品与b g二氧化锰混合,加热该混合物一段时间后(杂质不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如下表:
加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量(g) | c | d | e | e |
(i)进行加热操作时,应将固体置于________(填仪器名称)中。
(ii)该实验不必进行第五次加热的原因是_______。
(iii)若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况。______。
【答案】电解饱和食盐水 加快反应速率 Ca(ClO3)2 +2KCl=CaCl2+2KClO3↓ 重结晶 坩埚 剩余固体质量已恒重,说明KClO3已分解完全 ①未在干燥器中冷却,剩余固体吸水②加热时间不足,氯酸钾未完全分解(任写一种)
【解析】
(1)工业用电解饱和食盐水的方法生产氯气;
(2)温度升高有利于加快反应速率;
(3)热的氯酸钙与氯化钾反应生成溶解度更小的氯酸钾,用重结晶的方法可提纯氯酸钾晶体;
(4)(i)灼烧固体在坩埚中进行;
(ii)第三次和第四次的固体质量恒重,说明分解完全;
(iii)若某次测定结果的相对误差为-2.98%,说明所得数据偏小,可能为剩余固体质量偏大,据此分析。
(1)在工业上一般用电解饱和食盐水的方法生产氯气,反应方程式为: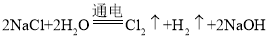 ;
;
(2)为加快反应速率,减少 Cl2与 Ca(OH)2之间发生副反应生成次氯酸钙,氯化过程需在较高的温度下进行;
(3)热的氯酸钙与氯化钾发生复分解反应生成溶解度更小的氯酸钾,反应为:Ca(ClO3)2 +2KCl=CaCl2+2KClO3↓;若反应得到的氯酸钾晶体中含有少量氯化钾,进一步提纯的方法可根据氯酸钾的溶解度受温度的影响变化较大,用重结晶的方法纯氯酸钾晶体;
(4)(i)灼烧固体要在坩埚中进行;
(ii)由表中数据可知,第三次和第四次的剩余固体质量已恒重,说明 此时KClO3已分解完全,因此无需再做第五次加热操作;
(iii)若某次测定结果的相对误差为-2.98%,说明所得数据偏小,可能为剩余固体质量偏大,可能为未在干燥器中冷却,剩余固体吸水(加热时间不足,氯酸钾未完全分解)。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 常温常压下,56g丙烯与环丁烷的混合气体中含有4NA个碳原子
B. 25℃,pH=1的H2SO4溶液中,H+的数目为0.2NA
C. 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
D. 1mol的P4O6中含有6 NA个P-O键(P4O6的结构如图: ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH=2的醋酸溶液,下列叙述正确的是( )
A. 该醋酸溶液的浓度为0.01mol/L
B. 加入少量CH3COONa固体,c(CH3COOH)增大
C. 溶液中离子浓度关系满足c(H+)>c(OH-)+c(CH3COO-)
D. 与等体积、pH=12的NaOH溶液混合后所得的溶液中c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3。试回答下列问题:
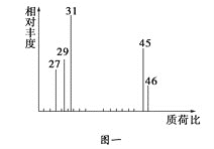
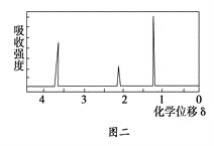
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)A的分子式是_______________________________________。
(4)A的结构简式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧碱、纯碱等都是重要的化工原料。
(1)利用如图装置可以证明二氧化碳与烧碱溶液发生了反应。
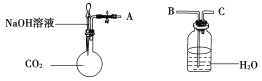
①若将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是________开始反应时的离子方程式是_______。
②若其他操作不变,将A与C连接,可观察到的现象是_______。
(2)向100mL 1mol·L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是Ⅰ.NaOH、Na2CO3,Ⅱ.________,Ⅲ.Na2CO3、NaHCO3,Ⅳ.________。
①常温下,将得到的固体X重新溶于水,在所得溶液中加入盐酸,使溶液的pH=7,再将溶液蒸干,得到固体的质量为________g。
②若要验证白色固体X是第Ⅰ种组成,依次加入的试剂为________(填字母序号)。
a.盐酸 b.MgCl2溶液 c.BaCl2溶液 d.Ba(OH)2溶液 e.酚酞试液
在验证的过程中,一定需要进行的操作是________(填字母序号)。
a.萃取 b.洗涤 c.过滤 d.分馏
③若白色固体X为第Ⅲ种组成,下列实验方案中不能测定其中NaHCO3质量分数的是________。
a.取m g X与足量Ba(OH)2溶液充分反应,过滤,洗涤,烘干得n g固体
b.取m g X与足量盐酸充分反应,加热,蒸干,灼烧得n g固体
c.取m g X充分加热,质量减少n g
d.取m g X与足量稀硫酸充分反应,逸出的气体被足量碱石灰吸收,增重n g
④若白色固体X的质量为7.0g,则X的组成为________(填“Ⅰ”、“Ⅱ”、“Ⅲ”或“Ⅳ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个铜锌双液原电池装置图,下列说法正确的是

A. 盐桥中的阴离子向CuSO4溶液中移动
B. 盐桥的作用之一是平衡电荷
C. 铜片作电池的负极
D. 电子从锌电极经溶液流向铜电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示。
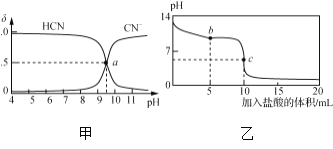
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 图甲中a点的溶液:c(CN-)<c(Cl-)
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)很多含氯物质都能做消毒剂。液氯可以用于饮用水消毒,但是消毒后的水中可能产生危害人体健康的有机氧化物。世界各国陆续开发新型自来水消毒剂,下列物质可以用于自来水消毒的有___。
A.Na2O2 B.Cl2O2 C.O3 D.O2 E.ClO2
(2)Na2FeO4为紫色物质,也可以用于自来水消毒,高铁酸钠处理过的水中含有氢氧化铁胶体,用激光笔照射,可以从侧面看到一条光路,这个现象在化学上被成为___。
(3)漂白液是一种常用消毒剂,其中的有效成分是___(写出化学式)。
(4)漂白粉也是常见消毒剂。工业上使用漂白粉一般加入少量盐酸或醋酸,促使___(填写出物质名称)产生,以增强漂白杀菌作用。请用化学方程式表示家用漂白粉不加入酸如何产生该物质___。
(5)漂白粉的质量靠它的“有效氯”衡量。有效氯是根据它同盐酸作用时产生的氯气量来计算的。请配平完成该过程的化学方程式:__Ca(ClO)2+__HCl=__Cl2↑+__CaCl2+__。生成的微量氯气与氢碘酸反应,可以得到碘单质,反应生成的碘与Na2S2O3可以定量的进行反应:2Na2S2O3+I2=Na2S4O6+2NaI,漂白粉的有效氯=(漂白粉加酸所释放出的氯气的质量/漂白粉的质量)×100%。漂白粉的有效氯一般高于30%,某化工厂漂白粉2g进行上述一系列反应进行测定,消耗硫代硫酸钠0.02mol,则其有效氯为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
实验现象 | 离子方程式 |
1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | ______ |
2.制备氢氧化铁胶体的化学方程式 | ______ |
3.二氧化硫使酸性高锰酸钾溶液褪色 | ______ |
4.Fe3O4溶于稀硝酸 | ______ |
5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | ______ |
6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | ______ |
7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | ______ |
8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | ______ |
9.FeI2与Cl2物质的量1∶2反应 | ______ |
10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | ______ |
11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | ______ |
12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | ______ |
13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 | ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com