
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,已用于宇宙飞船及潜艇中,其电极反应为:
负极:2H2+4OH--4e- 4H2O
4H2O
正极:O2+2H2O+4e- 4OH-
4OH-
所产生的水还可作为饮用水,今欲得常温下1 L水,则电池内电子转移的物质的量约为( )
| A.8.9×10-3 mol | B.4.5×10-2 mol | C.1.1×102 mol | D.5.6×10 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于原电池的叙述正确的是( )
| A.原电池工作时,电极上不一定都发生氧化还原反应 |
B.某可逆电池充、放电时的反应式为Li1-xNiO2+xLi LiNiO2,放电时此电池的负极材料是Li1-xNiO2 LiNiO2,放电时此电池的负极材料是Li1-xNiO2 |
| C.铅、银和盐酸构成的原电池工作时,铅板上有5.175 g铅溶解,正极上就有1 120 mL(标准状况)气体析出 |
| D.在理论上可将反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
结合下图判断,下列叙述正确的是( )
| A.Ⅰ和Ⅱ中正极均保护 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是( )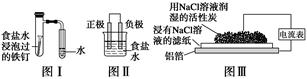
| A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 |
| B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁 |
| C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑ |
| D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min 间的平均反应速率和推测反应16 min 时反应物的浓度,结果应是( )。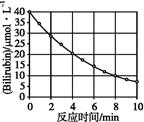
| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于原电池的叙述中正确的是( )。
| A.任何化学反应,均可以设计成原电池 |
| B.原电池是把化学能直接转化成电能的装置 |
| C.原电池的两极必须都是金属 |
| D.原电池都可以提供持续稳定的电流,应用十分广泛 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )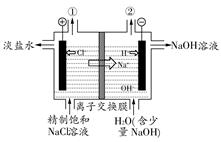
| A.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| B.该离子交换膜只能让阳离子通过,不能让阴离子通过 |
C.装置中发生反应的离子方程式为:2Cl-+2H+ Cl2↑+H2↑ Cl2↑+H2↑ |
| D.该装置是将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
以下现象与电化学腐蚀无关的是 ( )。
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.生铁比软铁芯(几乎是纯铁)容易生锈 |
| C.铁质器件附有铜质配件,在接触处易生铁锈 |
| D.银质奖牌久置后表面变暗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com