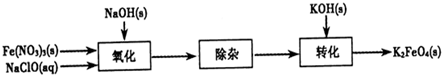
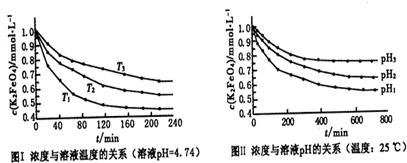
(2012?保定一模)【化学一化学与技术】
高铁酸钾(K
2FeO
4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如图:
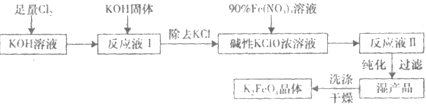
已知:
①温度较低时,Cl
2通入KOH溶液生成次级酸盐;温度较高时,Cl
2通入KOH溶液生成氯酸盐;
②Fe(NO
3)
3溶液与KClO溶液在强碱性环境中生成K
2FeO
4.请回答下列问题:
(1)该生产工艺应在
温度较低
温度较低
(填“温度较高”或“温度较低”)的情况下进行.
(2)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K
2FeO
4)进行消毒、净化以改善水质,其原因是
+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒,还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉
+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒,还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉
(3)经过高铁酸钾(K
2FeO
4)处理后的水不是纯净水,若要得到纯净水.可采用的净化方法是
蒸馏
蒸馏
(4)高铁酸钾溶于水形成浅紫红色溶液,溶液静置时会逐渐生成氧气并沉淀出三氧化二铁,此过程也会使溶液的pH增大.写出其化学方程式:
4K2FeO4+4H2O=2Fe2O3+8KOH+3O2↑
4K2FeO4+4H2O=2Fe2O3+8KOH+3O2↑
(5)在“反应液I”中加KOH固体的目的是为了①吸收“反应液I”中过量的Cl
2,生成更多的KClO;②
为下一步反应提供反应物
为下一步反应提供反应物
.
(6)从“反应液Ⅱ”中分离出K
2FeO
4后,副产品是
KNO3
KNO3
和
KCl
KCl
(写化学式).

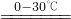 2K2FeO4+6KCl+8H2O 对于该反应,下列说法正确的
2K2FeO4+6KCl+8H2O 对于该反应,下列说法正确的