
| A. | 用100 mL容量瓶配制50 mL 0.1 mol/L盐酸 | |
| B. | 在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中称量 | |
| C. | 用25 mL量筒量取4.0 mol/L的盐酸5.62 mL | |
| D. | 用托盘天平准确称取5.85 g NaCl固体 |
分析 A.量筒量液时要注意量程的选择,应选择等于或略大于量取液体体积的量程;
B.氢氧化钠具有强腐蚀性,称量时应该放在小烧杯中快速称量;
C.量筒的最小读数为0.1mL,无法量取5.62mL盐酸;
D.托盘天平的最小读数为0.1g,无法称量5.85g氯化钠固体.
解答 解:A.用100 mL容量瓶配制50 mL 0.1 mol/L盐酸,应选择50mL的量筒,故A错误;
B.氢氧化钠具有腐蚀性,且容易潮解,所以在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中快速称量,故B正确;
C.量筒最小读数为0.1mL,所以无法用25mL量筒量取4.0mol/L的盐酸5.62mL,故C错误;
D.托盘天平的最小读数为0.1g,无法用托盘天平准确称取5.85g NaCl,只能称量5.9g氯化钠,故D错误;
故选B.
点评 本题考查物质的分离方法以及实验仪器的使用,题目难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )| A. | 原混合溶液中NO${\;}_{3}^{-}$的物质的量的浓度为4mol/L | |
| B. | AB段的反应为:Fe+2Fe3+=3Fe2+ | |
| C. | C点时,乙中溶质为FeSO4 | |
| D. | 标准状况下,OA,OB段产生的气体总体积约为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
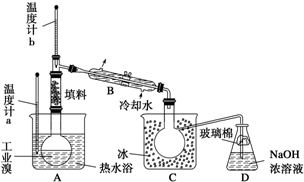 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图:
某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①⑤⑥ | C. | ②③④ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g 苯中含有的单键数目为0.9NA | |
| B. | 1 mol Cl2溶于水,与水反应时电子转移数目为1 NA | |
| C. | 在298K 1.01×105pa下,22 g CO2和N2O混合气体中,所占的体积大于11.2升 | |
| D. | 常温下,pH=13的NaOH溶液中含有的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除③外 | B. | 除④外 | C. | 除③④外 | D. | 除②⑥外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com