
| ·“Ó¦Ź±¼ä/min | n£ØMgSO4£©/mol | n£ØCO£©/mol | n£ØSO2£©/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A£® | 0”«2 minÄŚµÄĘ½¾łĖŁĀŹĪŖ¦Ō£ØCO£©=0.6 mol/£ØL•min£© | |
| B£® | 4 minŗó£¬Ę½ŗāŅĘ¶ÆµÄŌŅņæÉÄÜŹĒĻņČŻĘ÷ÖŠ¼ÓČėĮĖ2.0molµÄSO2 | |
| C£® | 4 minŗó£¬ČōÉżøßĪĀ¶Č£¬SO2ĪļÖŹµÄĮæÅØ¶Č±äĪŖ0.7mol/L£¬ŌņÕż·“Ó¦ĪŖ·ÅČČ·“Ó¦ | |
| D£® | ĘäĖūĢõ¼ž²»±ä£¬ČōĘšŹ¼Ź±ČŻĘ÷ÖŠMgSO4”¢CO¾łĪŖ1.0mol£¬ŌņĘ½ŗāŹ±n£ØSO2£©=0.6mol |
·ÖĪö A£®ÓɱķÖŠŹż¾Ż£¬æÉÖŖ2minÄŚ”÷n£ØCO£©=2mol-0.8mol=1.2mol£¬øł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖćv£ØCO£©£»
B.2minŹ±ĻūŗÄCOĪŖ1.2mol£¬ÓÉ·½³ĢŹ½æÉÖŖ”÷n£ØSO2£©=”÷n£ØCO£©=1.2mol£¬4minŹ±SO2ĪŖ1.2mol£¬ĖµĆ÷2min”¢4min“¦ÓŚĘ½ŗāדĢ¬£¬6minŹ±£¬COĪļÖŹµÄĮæŌö“ó£¬SO2µÄĪļÖŹµÄĮæŌö“ó£¬ĒŅ¶žŃõ»ÆĮņŌö“óøü¶ą£¬æÉÄÜŹĒ¼ÓČė¶žŃõ»ÆĮņ£¬½įŗĻCOŌö“óĮæ¼ĘĖćÓÖ×Ŗ»ÆµÄ¶žŃõ»ÆĮņ£¬½ų¶ų¼ĘĖć¼ÓČė¶žŃõ»ÆĮņµÄĪļÖŹµÄĮ棻
C£®4minĘ½ŗāŹ±c£ØSO2£©=$\frac{1.2mol}{2L}$=0.6mol/L£¬ČōÉżøßĪĀ¶Č£¬SO2ĪļÖŹµÄĮæÅØ¶Č±äĪŖ0.7mol/L£¾0.6mol/L£¬ĖµĆ÷ÉżøßĪĀ¶ČĘ½ŗāÕżĻņŅĘ¶Æ£»
D£®ĘäĖūĢõ¼ž²»±ä£¬ČōĘšŹ¼Ź±ČŻĘ÷ÖŠMgSO4”¢CO¾łĪŖ1.0mol£¬µČŠ§ĪŖŌŚŌĘ½ŗā»ł“”ÉĻŃ¹Ēæ¼õŠ”Ņ»±¶£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬CO×Ŗ»ÆĀŹŌö“ó£®
½ā“š ½ā£ŗA£®ÓɱķÖŠŹż¾Ż£¬æÉÖŖ2minÄŚ”÷n£ØCO£©=2mol-0.8mol=1.2mol£¬Ōņv£ØCO£©=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3mol/£ØL£®min£©£¬¹ŹA“ķĪó£»
B.2minŹ±ĻūŗÄCOĪŖ1.2mol£¬ÓÉ·½³ĢŹ½æÉÖŖ”÷n£ØSO2£©=”÷n£ØCO£©=1.2mol£¬4minŹ±SO2ĪŖ1.2mol£¬ĖµĆ÷2min”¢4min“¦ÓŚĘ½ŗāדĢ¬£¬6minŹ±£¬COĪļÖŹµÄĮæŌö“ó£¬SO2µÄĪļÖŹµÄĮæŌö“ó£¬ĒŅ¶žŃõ»ÆĮņŌö“óøü¶ą£¬æÉÄÜŹĒ¼ÓČė¶žŃõ»ÆĮņ£¬COŌö“ó1.2mol-0.8mol=0.4mol£¬ŌņÓÖ×Ŗ»ÆµÄ¶žŃõ»ÆĮņĪŖ0.4mol£¬ĻņČŻĘ÷ÖŠ¼ÓČėĮĖµÄSO2ĪŖ2.8mol+0.4mol-1.2mol=2mol£¬¹ŹBÕżČ·£»
C£®4minĘ½ŗāŹ±c£ØSO2£©=$\frac{1.2mol}{2L}$=0.6mol/L£¬ČōÉżøßĪĀ¶Č£¬SO2ĪļÖŹµÄĮæÅØ¶Č±äĪŖ0.7mol/L£¾0.6mol/L£¬ĖµĆ÷ÉżøßĪĀ¶ČĘ½ŗāÕżĻņŅĘ¶Æ£¬ŌņÕż·“Ó¦ĪŖĪüČČ·“Ó¦£¬¹ŹC“ķĪó£»
D£®ĘäĖūĢõ¼ž²»±ä£¬ČōĘšŹ¼Ź±ČŻĘ÷ÖŠMgSO4”¢CO¾łĪŖ1.0mol£¬µČŠ§ĪŖŌŚŌĘ½ŗā»ł“”ÉĻŃ¹Ēæ¼õŠ”Ņ»±¶£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬CO×Ŗ»ÆĀŹŌö“ó£¬ŌņĘ½ŗāŹ±n£ØSO2£©£¾1.2mol”Į$\frac{1mol}{2mol}$=0.6mol£¬¹ŹD“ķĪó£¬
¹ŹŃ”£ŗB£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗā¼ĘĖćÓėÓ°ĻģŅņĖŲ”¢·“Ó¦ĖŁĀŹ¼ĘĖćµČ£¬DŃ”Ļī×¢ŅāĄūÓƵȊ§Ę½ŗā·ÖĪö½ā“š£¬æÉŅŌĄūÓĆĘ½ŗā³£Źż¼ĘĖć¾ßĢåµÄÖµ£¬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹żŃõ»ÆĒāŹĒÓÉĒāĘųŗĶŃõĘų×é³ÉµÄ | |
| B£® | ĖüŹĒÓÉ2øöĒāŌŖĖŲŗĶ2øöŃõŌŖĖŲ×é³ÉµÄ | |
| C£® | ¹żŃõ»ÆĒāŌŚ¶žŃõ»ÆĆĢ×÷ÓĆĻĀÄÜÉś³ÉĖ®ŗĶŃõĘų£¬øĆ·“Ó¦ĪŖø“·Ö½ā·“Ó¦ | |
| D£® | Ćæøö¹żŃõ»ÆĒā·Ö×ÓÖŠŗ¬ÓŠ2øöĒāŌ×ÓŗĶ2øöŃõŌ×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1 mL pH=1µÄŃĪĖįÓė100 mLNaOHČÜŅŗ»ģŗĻŗó£¬ČÜŅŗµÄpH=7£¬ŌņNaOHČÜŅŗµÄpH=11 | |
| B£® | ŌŚµĪÓŠ·ÓĢŖµÄ°±Ė®Ąļ£¬¼ÓČėNH4ClÖĮČÜŅŗĒ”ŗĆĪŽÉ«£¬Ōņ“ĖŹ±ČÜŅŗµÄpH£¼7 | |
| C£® | 1.0”Į10”„8mol•L-1ŃĪĖįµÄpH=8.0 | |
| D£® | ij“×ĖįČÜŅŗµÄpH=a£¬½«“ĖČÜŅŗĻ”ŹĶ1±¶ŗó£¬ČÜŅŗµÄpH=b£¬Ōņa£¾b |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā

 £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČČĪČ¶ØŠŌ£ŗNa2CO3£¾NaHCO3 | B£® | ·Ē½šŹōŠŌ£ŗCl£¾Br | ||
| C£® | ¼īŠŌ£ŗNaOH£¾Mg£ØOH£©2 | D£® | ĖįŠŌ£ŗH2SO4£¾H3PO4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
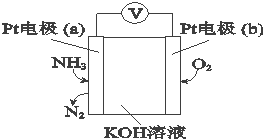
| A£® | O2ŌŚµē¼«bÉĻ·¢Éś»¹Ō·“Ó¦ | |
| B£® | ČÜŅŗÖŠOH-Ļņµē¼«aŅĘ¶Æ | |
| C£® | ·“Ó¦ĻūŗĵÄNH3ÓėO2µÄĪļÖŹµÄĮæÖ®±ČĪŖ3£ŗ4 | |
| D£® | øŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ2NH3-6e-+6OH-ØTN2+6H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øÖŹĒÓĆĮæ×ī“óµÄŗĻ½š | |
| B£® | ĀĮļ®ŗĻ½šæ¹øÆŹ“ÄÜĮ¦ŗÜĒ棬æÉÄĶĖį¼īøÆŹ“ | |
| C£® | ĪŅ¹śŌŚÉĢ“ś¾ĶæŖŹ¼Ź¹ÓĆĶŗĻ½š | |
| D£® | ĀĮŗĻ½šµÄĒæ¶Č”¢Ó²¶Č±Č“æĀĮ“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Įņ»ÆÄĘŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£®¹¤ŅµÉĻÓĆĮņĖįÄĘÓėĢ¼·“Ó¦µĆµ½Įņ»ÆÄĘ£®·“Ó¦·½³ĢŹ½ČēĻĀ£ŗ
Įņ»ÆÄĘŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£®¹¤ŅµÉĻÓĆĮņĖįÄĘÓėĢ¼·“Ó¦µĆµ½Įņ»ÆÄĘ£®·“Ó¦·½³ĢŹ½ČēĻĀ£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com