
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
分析 (1)T2℃时,pH=11的苛性钠溶液中氢氧根的浓度是0.1mol/L,V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,说明稀硫酸过量,则$\frac{{0.1{V_1}-0.1{V_2}}}{{{V_1}+{V_2}}}=0.01$,解得V1:V2=9:11.溶液显酸性,则此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-);
(2)①中c(OH-)=0.01mol/L×5×10-5/0.005L=1×10-4mol/L,②溶液中c(H+)=1×10-4mol/L,溶液中c(OH-)=10-14/1×10-4mol/L=1×10-10mol/L,所以①和②溶液中c(OH-)之比=1×10-4mol/L:1×10-10mol/L=106:1;
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11,这说明偏铝酸根离子的水解程度大于碳酸氢根离子的水解程度,所以将两种溶液等体积混合发生反应生成碳酸钠和氢氧化铝,离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,可能发生的现象是由白色沉淀生成;
(4)双氧水具有强氧化性,能把铁氧化为铁离子,因此加入稀硫酸和双氧水,溶解后铁变为硫酸铁.根据氢氧化铁的溶度积常数可知,当铁离子完全沉淀时溶液中铁离子浓度为10-5mol/L,则溶液中氢氧根的浓度=$\root{3}{{\frac{{{{10}^{---39}}}}{{{{10}^{---5}}}}}}=5×{10^{---12}}mol/L$,所以氢离子浓度是2×10-3mol/L,pH=2.7,因此加碱调节pH为2.7时铁刚好完全沉淀.Zn2+浓度为0.1mol/L,根据氢氧化锌的溶度积常数可知开始沉淀时的氢氧根浓度为=$\sqrt{\frac{{{{10}^{-17}}}}{0.1}}$=10-8mol/L,氢离子浓度是10-6mol/L,pH=6,即继续加碱调节pH为6时锌开始沉淀.如果不加双氧水,则铁与稀硫酸反应生成硫酸亚铁,由于氢氧化亚铁和氢氧化锌的溶度积常数接近,因此在沉淀锌离子的同时亚铁离子也沉淀,导致生成的氢氧化锌不纯,无法分离开Zn2+和Fe2+.
解答 解:(1)混合液的pH=2,酸过量,c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{总}}$=$\frac{0.1mol/L×{V}_{2}L-0.1mol/L×{V}_{1}L}{{V}_{1}+{V}_{2}}$=0.01,
解之得:$\frac{{V}_{1}}{{V}_{2}}$=9:11,
c(Na+)=0.1×9/(9+11)=0.045mol/L
c(SO42-)=0.05×11/20=0.0275mol/L
c(H+)=0.01mol/L
硫酸过量溶液显酸性,c 则(H+)>c (OH-),
故溶液中各种离子的浓度由大到小的排列顺序是:c (Na+)>c (SO42-)>c (H+)>c (OH-),
故答案为:9:11;c(Na+)>c(SO42-)>c(H+)>c(OH-).
(2)①多加了1滴NaOH溶液,为碱溶液,c(OH-)=$\frac{0.05×0.01}{5}$=10-4mol/L;②少加1滴NaOH溶液,为酸溶液,c(H+)=$\frac{0.025×0.02×2}{5}$=10-4mol/L,c(OH-)=10-10mol/L,则①和②溶液中c(OH-)之比是106:1,
故答案为:106:1;
(3)水解均显碱性,由pH的大小可知,等体积混合时AlO2-促进HCO3-的电离,发生AlO2-+HCO3-+H2O=Al(0H)3↓+CO32-,观察到白色沉淀,
故答案为:白色沉淀;AlO2-+HCO3-+H2O=Al(0H)3↓+CO32-;
(4)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol•L-1,因Ksp=10-39,
则c(OH-)=$\root{3}{\frac{1{0}^{-39}}{1{0}^{-5}}}$mol/L≈0.5×10-11mol/L,此时pH=2.7,如锌开始沉淀,则c(OH-)=$\sqrt{\frac{1{0}^{-17}}{0.1}}$mol/L=10-8mol/L,此时pH=6,由表中数据可知Zn(OH)2、Fe(OH)2的Ksp相近,如不加H2O2,则Zn2+和Fe2+分离不开,
故答案为:Fe3+;2.7;6;Zn2+和Fe2+分离不开;Fe(OH)2和Zn(OH)2的Ksp相近;
点评 本题考查原电池知识以及物质的分离、提纯,侧重于原电池的工作原理以及实验基本操作和注意问题,题目难度中等,有利于培养学生良好的科学素养.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、HCO3-、MnO4- | B. | Al3+、Mg2+、HCO3- | ||
| C. | Al3+、Mg2+、SO42- | D. | Al3+、Mg2+、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
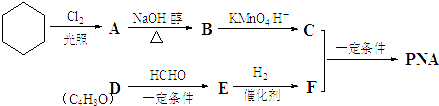
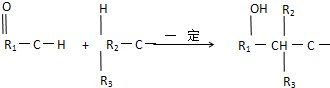 (R1、R2、R3代表烃基
(R1、R2、R3代表烃基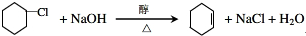 .
. .
.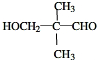 .
. .
.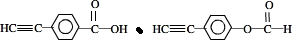 .
.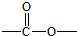 基团
基团查看答案和解析>>
科目:高中化学 来源: 题型:解答题
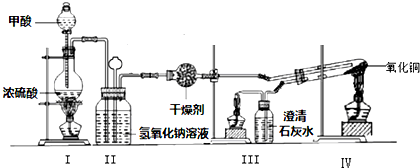
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据其结构判断该含氧酸为强酸 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线形非极性分子 | D. | 该分子的电子式是H:O:Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素均为金属元素 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 含离子键的晶体一定是离子晶体,含共价键的晶体一定是分子晶体 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com