
| A. | “哑泉”之毒是由于水中的Cu2+使人体中的蛋白质分解 | |
| B. | “哑泉”之毒是由于水中的SO42-使人体中的蛋白质变性 | |
| C. | “哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性 | |
| D. | “安乐泉”能解“哑泉”之毒的离子方程式为Cu2++2OH-=Cu(OH)2↓ |
分析 “哑泉”水中溶有CuSO4,铜离子能使蛋白质发生变性,与“安乐泉”(水质偏碱性)反应生成氢氧化铜沉淀,铜离子浓度降低,以此来解答.
解答 解:A.哑泉有毒是因为含有的硫酸铜电离出的铜离子为重金属离子,重金属离子能使蛋白质变性,故A错误;
B.SO42-不能使人体中的蛋白质变性,故B错误;
C.铜离子为重金属离子,重金属离子能使蛋白质变性,与水解无关,故C错误;
D.要解哑泉之毒就是使可溶性的铜离子转变成沉淀,离子方程式为Cu2++2OH-=Cu(OH)2↓,故D正确.
故选D.
点评 本题考查铜盐及性质,为高频考点,把握习题中的信息、蛋白质的变性、离子反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥③⑥⑤⑥ | B. | ②⑥③⑥⑤⑥ | C. | ①⑥④⑥⑤⑥ | D. | ②⑥④⑥⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对叔丁基苯酚
对叔丁基苯酚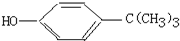 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CC1]等为原料制备对叔丁基苯酚,已知叔丁基氯熔点(℃)-25.4沸点(℃):51
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CC1]等为原料制备对叔丁基苯酚,已知叔丁基氯熔点(℃)-25.4沸点(℃):51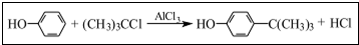 .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体能发生电泳现象 | B. | 胶体能产生丁达尔现象 | ||
| C. | 胶体粒子直径在1~100nm之间 | D. | 胶体在一定条件下能聚沉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若A是金属铁,则B溶液可使酸性高锰酸钾溶液褪色 | |
| B. | 若A、B、C中均含同一种常见金属元素,且该元素在C中以阴离子形式存在,则A溶液与C溶液可发生反应生成白色沉淀 | |
| C. | 若A、B、C的焰色反应均呈黄色,水溶液均为碱性,则X不可能为直线形分子 | |
| D. | 若A为固态非金属单质,A与X同周期,则C中所有原子可能都满足8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉溶液、CuO、HClO、Cu | |
| B. | 普通玻璃、H2O、FeCl3、葡萄糖 | |
| C. | 水银、Na2O、BaSO4、SO3 | |
| D. | KAl(SO4)2•12H2O、KClO3、NH3•H2O、CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com