
| A.3种 | B.4种 | C.5种 | D.6种 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.2ω1 = ω2 | B.2ω2 = ω1 | C.ω2 > 2ω1 | D.ω1 < ω2 < 2ω1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。 里哪些物质和起什么作用 。
里哪些物质和起什么作用 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 KIO3 +3H2↑。
KIO3 +3H2↑。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CuO, CuO+2HNO3=Cu(NO3)2+H2O;
2CuO, CuO+2HNO3=Cu(NO3)2+H2O; 3Cu(NO3)2+2NO↑+4H2O;
3Cu(NO3)2+2NO↑+4H2O;| A.三方案中所涉及的反应都属于氧化还原反应 |
| B.三方案中硝酸的利用率②>①>③ |
| C.制取相同量的硝酸铜②产生的有害气体比③多 |
| D.三种方案中①方案最优 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 氮的叙述正确的是
氮的叙述正确的是| A.一氧化氮是一种红棕色的气体 |
| B.常温常压下,一氧化氮不能与空气中的氧气直接化合 |
| C.一氧化氮易溶于水,不能用排水法收集 |
| D.一氧化氮可以由氮气和氧气在放电条件下直接化合得到 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
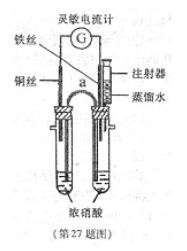
| 实验次数 | 实验温度(℃) | 注入水的体积(mL) |
| 1 | 17.2 | 2.4 |
| 2 | T1 | 2.5 |
| 3 | T2 | 2.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com