
| A. | ${\;}_{10}^{20}$Ne和${\;}_{10}^{22}$Ne的中子数相同,所以${\;}_{10}^{20}$Ne和${\;}_{10}^{22}$Ne互为同位素 | |
| B. | 1mol CH4与1mol NH${\;}_{4}^{+}$所含质子数相等 | |
| C. | 二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 | |
| D. | 等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 |
分析 A.依据质量数=质子数+中子数计算解答;
B.1个甲烷分子含有10个质子;1个氨根离子含有11个质子;
C.电解质必须本身能够电离;
D.1个甲基含有9个电子,1个羟基含有9个电子.
解答 解:A.${\;}_{10}^{20}$Ne和${\;}_{10}^{22}$Ne中子数分别为:20-10=10,22-10=12,二者中子数不同,故A错误;
B.1个甲烷分子含有10个质子;1个氨根离子含有11个质子,所以1mol CH4与1mol NH${\;}_{4}^{+}$所含质子数分别为10mol和11mol,二者不同,故B错误;
C.二氧化硫本身不能电离产生自由离子而导电,属于非电解质,故C错误;
D.1个甲基含有9个电子,1个羟基含有9个电子,所以等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等,故D正确;
故选:D.
点评 本题考查了质量数、质子数、中子数的计算、电解质的判断,明确原子符号的意义明确质量数=质子数+中子数是解题关键,题目难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 丁醛 | B. | 正丁醛的同系物 | ||
| C. | CH3CH2COCH3 (2-丁酮) | D. | CH2=C(CH3)CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 6.72L | C. | 8.4L | D. | 2.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用一种原子制造出另一种或几种原子 | |
| B. | 碳酸氢铵受热分解 | |
| C. | 蓝矾加热后变为白色固体 | |
| D. | 电解水生成氢气和氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫能使溴水褪色,说明二氧化硫具有漂白性 | |
| B. | 漂白粉和明矾都常用于处理自来水,二者的作用的原理相同 | |
| C. | 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可用酸性高锰酸钾溶液 | |
| D. | 金属单质Na、Al、Fe在一定条件下与水反应都生成氢气和对应的碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L O2一定含有NA个氧分子 | |
| B. | 1mol H2的质量只有在标准状况下才约为2g | |
| C. | 标准状况下,18g水的体积为22.4L | |
| D. | 1mol H2和O2的混合气体在标准状况下的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
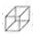 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: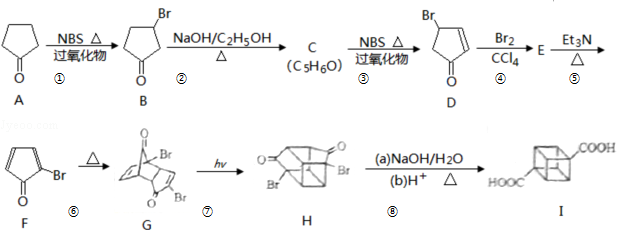
 .
.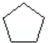 $\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$
$\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$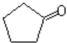 反应I的试剂与条件为Cl2/光照,反应2的化学方程式为
反应I的试剂与条件为Cl2/光照,反应2的化学方程式为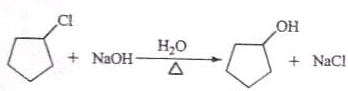 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 | |
| B. | 加强化石燃料的开采利用,能从根本上解决能源危机 | |
| C. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com