
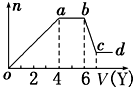
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
分析 (1)无色溶液中不会含有Fe3+,加入盐酸后能形成的沉淀有Al(OH)3、H2SiO3,前者能溶于过量盐酸中而后者不能,由图象知溶液中肯定含有AlO2-、SiO32-.
oa段发生反应的离子为AlO2-、SiO32-,ab段为CO32-,bc段则是Al(OH)3溶解;
(2)当向溶液中加入NaOH时,生成的沉淀为Mg(OH)2、Al(OH)3,ab段是NH4+与OH-之间发生反应,因Mg2+、Al3+不能与CO32-、SiO32-、AlO2-共存,故此时溶液中阴离子只有Cl-.结合图象,溶解Al(OH)3、与NH4+作用、生成Al(OH)3消耗的NaOH体积比为1:2:3;由此可求出与Mg2+反应时消耗的NaOH体积与溶解Al(OH)3消耗NaOH 溶液一样多,故溶液中n(Al3+):n(Mg2+):n(NH4+)=2:1:4,最后就得到各种离子物质的量比.
解答 解:(1)某无色稀溶液X中,无色溶液中不会含有Fe3+,加入盐酸后能形成的沉淀有Al(OH)3、H2SiO3,前者能溶于过量盐酸中而后者不能,所以由图象知溶液中含有SiO32-、AlO2-;则oa段发生反应的离子为AlO2-、SiO32-;ab段发生的反应沉淀的量不变,所以ab段为盐酸与CO32-反应,bc段沉淀减少,则是Al(OH)3溶解于盐酸,其反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O.
故答案为:AlO2-、SiO32-;CO32-;Al(OH)3+3H+=Al3++3H2O;
(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,溶液中可能含Al3+、Mg2+或两者中的一种,由于弱碱阳离子和弱酸根会双水解而不能共存,即溶液中不含CO32-、SiO32-、AlO2-,由于溶液一定要保持电中性,故溶液中一定含Cl-;当a-b段时,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH4++OH-═NH3•H2O,即溶液中含NH4+;当b-c段时沉淀的质量减少但没有完全溶解,即部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有Al3+、Mg2+,即bc段的反应为:Al(OH)3+OH-═AlO2-+2H2O.
即则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-;由于溶液中有Al3+、Mg2+,故oa段转化为沉淀的离子是Al3+、Mg2+,ab段是氢氧化钠和铵根离子反应生成气体,反应的离子方程式为NH4++OH-═NH3•H2O;溶液中有Al3+、Mg2+,即沉淀中含Al(OH)3和Mg(OH)2,故bc段的反应为:Al(OH)3+OH-═AlO2-+2H2O,
NH4+反应需要NaOH的体积是2V,由于Al(OH)3溶解时需要的NaOH的体积是V,则生成Al(OH)3需要的NaOH的体积是3V,而生成Mg(OH)2和Al(OH)3共消耗NaOH的体积为4V,则生成Mg(OH)2需要NaOH溶液的体积是V,则n(Al3+):n(Mg2+):n(NH4+)=2:1:4,
故答案为:Al3+、Mg2+、NH4+;2:1:4;NH4++OH-═NH3•H2O.
点评 本题考查离子检验及离子反应,根据溶液的颜色结合题给图象确定溶液中存在的离子,再结合物质之间的反应来确定微粒的量,同时考查学生思维的缜密性、考虑问题的全面性,题目难度较大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁红属于盐类 | B. | 明矾属于碱类 | ||
| C. | SiO2属于酸性氧化物 | D. | NaHCO3属于酸类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4Q1+0.05Q2 | B. | 0.4Q1+0.05Q3 | C. | 0.4Q1+0.1Q3 | D. | 0.4Q1+0.2Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只能有一种分类标准 | B. | 分类标准不同,物质所属类别不同 | ||
| C. | 可能有多种分类标准 | D. | 一种分类标准对应一种分类结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-4 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(HCl):用饱和NaHCO3溶液 | B. | CO2(SO2):用饱和KMnO4溶液 | ||
| C. | Cl2(HCl):用饱和NaCl溶液 | D. | SO2(HCl):用饱和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
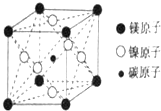 最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )| A. | MgCNi3 | B. | Mg2CNi3 | C. | MgCNi2 | D. | MgC2Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com