
下列有关金属的腐蚀与防护的说法中,不正确的是
| A.温度越高,金属腐蚀速率越快 |
| B.在铁管外壁上镀锌可防止其被腐蚀 |
| C.金属被腐蚀的本质是金属发生了氧化反应 |
| D.将钢闸门与直流电源的正极相连可防止其被腐蚀 |
科目:高中化学 来源: 题型:单选题
对于锌、铜和稀硫酸组成的原电池(如下图),下列有关说法错误的是
| A.溶液中H+向负极移动 | B.电子由Zn经外电路流向Cu |
| C.Zn电极反应:Zn-2e-=Zn2+ | D.Cu是正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )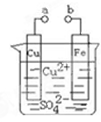
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于写图所示原电池的叙述中,正确的是
| A.质量减轻的一极是铜极 |
| B.负极反应为Fe—2e→ Fe2+ |
| C.该装置将电能转变为化学能 |
| D.电流由负极经导线流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。)
依据记录数据判断,下列结论中正确的是
| A.将甲、乙形成的合金露置在空气中,甲先被腐蚀 |
| B.金属乙能从硫酸铜溶液中置换出铜 |
| C.在四种金属中丙的还原性最弱 |
| D.甲、丁若形成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铜、锌和硫酸构成的原电池中,当导线中有1 mol电子通过时,理论上两极的变化是( )
①锌片溶解32.5 g ②锌片增重32.5 g ③铜片上析出1 g H2 ④铜片上析出1 mol H2
| A.①③ | B.①④ | C.②③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为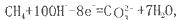 ,下列叙述正确的是
,下列叙述正确的是
| A.通入甲烷的一极为正极 |
| B.通入氧气的一极发生氧化反应 |
C.该电池总反应为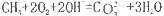 |
| D.该电池在工作时,溶液中的阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
人造地球卫星用的一种高能电池——银锌电池,该电池的电极反应式为:
Zn+2OH- -2e- = ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,据此判断氧化银是( )
| A.负极,并被氧化 | B.正极,并被还原 |
| C.负极,并被还原 | D.正极,并被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是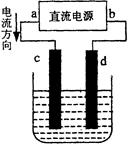
| A.a为负极、b为正极 | B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 | D.电解过程中,氯离子浓度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com