
����Ŀ��ijʵ��С��ͬѧ�Ե绯ѧԭ��������һϵ��̽�����
��1����ͼΪijʵ��С������������ԭ��Ӧ��(�����ӷ���ʽ��ʾ) �� ��Ƶ�ԭ���װ�ã���Ӧǰ���缫������ȣ�һ��ʱ������缫�������12 g��������ͨ��mol���ӡ�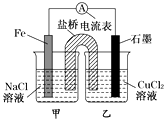
��2��������������Ƭ������Һ���������Թ��У������еμ��������Ʊ�����ˮ��д��������Ӧ�����ӷ���ʽ �� Ȼ��μӼ������軯����Һ����Һ��죬�����μӹ������Ʊ�����ˮ����ɫ��ȥ��ͬѧ�ǶԴ����˶��ּ��裬ijͬѧ�ļ����ǣ�����Һ�еģ�3����������Ϊ���ߵļ�̬���������3����������ΪFeO ![]() ����д���÷�Ӧ�����ӷ���ʽ��
����д���÷�Ӧ�����ӷ���ʽ��
��3����ͼ�����������䣬�������Ż�����ͭ������ʯī������n�ͣ���ͼ��ʾ��һ��ʱ����ڼ�װ��ͭ˿�����μӷ�̪��Һ����������Һ��죬�缫��ӦΪ����װ����ʯī(1)Ϊ��(���������������������������)����װ������ͭ˿����ʯī�缫�Ϸ����ķ�ӦʽΪ��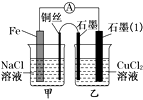
��4���۲���ͼ��ʾ������װ�ã�ͼ1װ����ͭ�缫�ϲ�����������ɫ���ݣ�ͼ2װ����ͭ�缫������������������缫�ϲ�����������ɫ���塣���������������Ʋ���������е�������Ҫ��ѧ����Ϊ����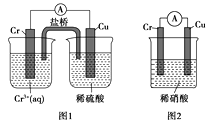
���𰸡�
��1��Fe��Cu2��=Fe2����Cu,0.2
��2��2Fe2����Cl2=2Fe3����2Cl��, 2Fe3����3Cl2��8H2O=2FeO42����6Cl����16H��
��3��O2��2H2O��4e��=4OH��,��,2Cl����2e��=Cl2��
��4���������Ļ�Ա�ͭ��ǿ���ܺ�ϡ���ᷴӦ����H2,�������ױ�ϡ����ۻ�
����������1��ͼ1Ϊԭ��ط�Ӧ��FeΪ������������Fe-2e��=Fe2+��ʯīΪ����������Cu2��+2e��=Cu���ܷ�ӦʽΪFe+Cu2���TFe2��+Cu��һ��ʱ������缫�������12g����
Fe+Cu2���TFe2��+ | Cu | �����������m | ת�Ƶ��� |
56g+64g=120g | 2mol | ||
12g | n |
��ã�n=0.2mol��
��2��������������Ƭ������Һ��FeΪ������������Fe-2e��=Fe2+�������еμ��������Ʊ�����ˮ��������Fe2�������� 2Fe2����Cl2=2Fe3����2Cl�� �������3����������ΪFeO42�����䷴Ӧ�����ӷ���ʽΪ��2Fe3��+3Cl2+8H2O=2FeO42��+6Cl��+16H����
��3����ͼ�����������䣬�������Ż�����ͭ������ʯī������n�ͣ���װ��Ϊ����������ʴ����Ϊ������ͭΪ�������������� O2+2H2O+4e���T4OH�����ʼ��ԣ��μӷ�̪����Һ��죬����װ������������ʯīΪ��������ͭ������ʯīΪ�����������ķ�ӦΪ��2Cl����2e��=Cl2����
��4����ͼ1��֪��ԭ��Cr��Cu���������Ļ�Ա�ͭ��ǿ���ܺ�ϡ���ᷴӦ����H2������ϡ������ȴ�����˷��������ϡ����������ԣ������Ʋ����ϡ����ۻ������»��Խ��ͣ��ʴ�Ϊ���������Ļ�Ա�ͭ��ǿ���ܺ�ϡ���ᷴӦ����H2���������ױ�ϡ����ۻ���
��1�������Է�������ԭ��Ӧ֪ʶ����д��������������Ӧ������������仯���м��㣻
��2�������������ӱ�����������д���ӷ���ʽ�����������ӱ�����Ϊ�������������д���ӷ���ʽ��
��3�����ݵ��ء�ԭ��صĹ���ԭ�����лش�
��4�����ݽ�����ǿ�����з���.


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ס��ҡ�����X��������ѧ��ѧ�г��������ʣ���ת����ϵ����ͼ�����X��������
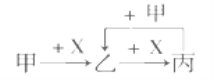
A. ��ΪC��X��O2 B. ��ΪCO2��X��NaOH��Һ
C. ��ΪCl2��XΪFe D. ��ΪAl��XΪNaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������100mL��Cu2+��Al3+��NH4+��H+��Cl������Һ�������Һ����μ���2.5mol/LNaOH��Һ������NaOH ��Һ�������mL����������������ʵ�����mol����ϵ����ͼ��ʾ��

��1��B��ij�����Ļ�ѧʽΪ______________��
��2��ԭ��Һ��Cu2+�����ʵ���Ϊ______��ԭ��Һ��Cl�����ʵ���Ũ��Ϊ________��x-y=__________��
����A��B��C��DΪ��ѧ���������Ҿ�����ͬһ��Ԫ�أ��ת����ϵ��ͼ(��Ӧ���������������Ѿ���ȥ)��
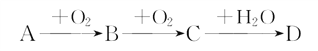
��1����A��ˮ��Һ��ʹʪ��ĺ�ɫʯ����ֽ������D��ϡ��Һ��ʹʪ�����ɫʯ����ֽ��졣��D�Ļ�ѧʽΪ___________��
��2����AΪ���ʣ�DΪǿ�������Ԫ�ص�ԭ���������ӵ���ĿС��18��д��C��D�Ļ�ѧ����ʽ��_____________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڵ�����2%ת��Ϊ�����Լ�ǿ�Ļ���������Щ�������ܼ�������˥�ϣ�����Ϊ������ɱ�������й���ѧ�ҳ�����Na2SeO3��������ڻ�������Na2SeO3�������ǣ� ��
A. ��ԭ��B. ������
C. �������������ǻ�ԭ��D. �Ȳ����������ֲ��ǻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��ش����⣺
��1����ͼ��1 mol NO2(g)��1 mol CO(g)��Ӧ����CO2��NO�����е������仯ʾ��ͼ�����ڷ�Ӧ��ϵ�м����������Ӧ��������E1�ı仯��(�������С�����䡱����ͬ)����H�ı仯����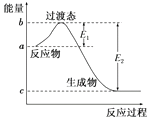
��2��0.1 mol Cl2�뽹̿��TiO2��ȫ��Ӧ������һ�ֻ�ԭ�������һ����ˮ���TiO2��xH2O��Һ̬���������4.28 kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��
��3���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧ���Ȼ�ѧ����ʽ���£�
��CH3OH(g)��H2O(g)=CO2(g)��3H2(g) ��H����49.0 kJ��mol��1
��CH3OH(g)�� ![]() O2(g)=CO2(g)��2H2(g) ��H����192.9 kJ��mol��1
O2(g)=CO2(g)��2H2(g) ��H����192.9 kJ��mol��1
��֪��H2O(g)=H2O(l) ��H����44 kJ��mol��1 �� ��״�����ȼ��ΪҺ̬ˮ���Ȼ�ѧ����ʽΪ��
��4�����������õ������£�NH ����������Ӧ��������NO ���������������仯��ͼ��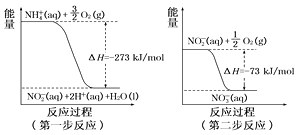
�ڶ�����Ӧ����Ӧ(����ȡ������ȡ�)��1 mol NH4+(aq)ȫ��������NO (aq)���Ȼ�ѧ����ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.����ռ�һ���Ǽ�B.SiO2��SO2��������������
C.���ܵ����H���Ļ�����һ������D.��������һ�����н�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ�з��ϰ�ȫҪ�����
A. ����ú��ʹ�û������
B. �����ڼ䣬�ڿ����Ĺ㳡ȼ���̻�����
C. �õ�ȼ�Ļ����Һ������ƿ�ڼ����Ƿ�©��
D. ʵ��ʱ����ˮ����Ũ��������ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3���Լױ���ϩ�������E����һ�����ںϳɿ�Ѫ˨ҩ���м��壬��ϳ�·�����£� 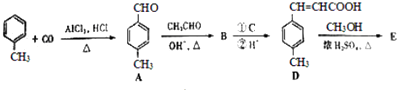
��֪��HCHO+CH3CHO ![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
��1����FeCl3��Һ����ɫ�ұ�����������ȡ������A��ͬ���칹�����֣�B�к��������ŵ�����Ϊ ��
��2���Լ�C��ѡ�������е� ��
a����ˮ
b��������Һ
c������KMnO4��Һ
d������Cu��OH��2����Һ
��3��![]() ��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ ��
��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ ��
��4��E��һ�������¿������ɸ߾���F��F�Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com