
分析 试管内剩余1mL气体为氧气,发生的反应方程式为:4NO2+O2+2H2O═4HNO3,若剩余气体为NO,还发生反应:3NO2+2H2O═2HNO3+NO,结合方程式计算.
解答 解:NO2和O2混合气体的试管倒立于水中,发生反应:4NO2+O2+2H2O=4HNO3 最后剩余气体可能为氧气,也可能是NO气体.
若剩余气体为氧气,参加反应气体总体积为13mL-1mL=12mL,由4NO2+O2+2H2O=4HNO3可知,NO2为12mL×$\frac{4}{5}$=9.6mL,氧气为13mL-9.6mol=3.4mL;
若剩余气体为NO气体,则发生反应3NO2+H2O=2HNO3+NO的NO2为1mL×3=3mL,反应4NO2+O2+2H2O=4HNO3消耗的气体总体积为13mL-3mL=10mL,该反应中O2为10mL×$\frac{1}{5}$=2mL,故NO2的总体积为13mL-2mL=11mL,
答:原混合气体中NO2和O2的体积为分别为V(NO2)=9.6mL、V(O2)=3.4mL或V(NO2)=11mL、V(O2)=2mL.
点评 本题考查混合物有关计算,题目难度中等,关键是分析剩余气体的成分,再根据反应的方程式计算,试题培养了学生的分析及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.44S | B. | 1S | C. | 1.33S | D. | 2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠溶液 | B. | AgN03溶液 | C. | 碳酸钠溶液 | D. | 紫色石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 常温常压,完全燃烧时消耗的O2一定是$\frac{33.6a}{14}$L | |
| C. | 所含共用电子对数目为($\frac{a}{7+1}$)NA | |
| D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液褪色 | B. | 产生白色沉淀 | C. | 无明显现象 | D. | 产生黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HCO3-)=c(CO32-) | B. | 溶液中无H2CO3 | ||
| C. | c(HCO3-)恒定不变 | D. | 溶液中H2CO3、HCO3-、CO32-共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 改变条件 | 平衡移动方向 | 导电能力 |
| A | 加入蒸馏水 | 逆向移动 | 减弱 |
| B | 加入少量冰醋酸 | 正向移动 | 增强 |
| C | 加入少量CH3COONa固体 | 正向移动 | 增强 |
| D | 加入少量0.1mol•L-1的稀硫酸 | 逆向移动 | 减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
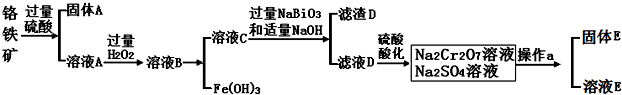
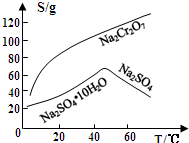

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com