
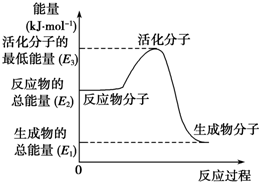
 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是| A. | 上述图示的反应为吸热反应 | |
| B. | 图中的能量变化如图所示,则△H=E1-E3 | |
| C. | H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 | |
| D. | 根据①②推知:在25℃、101 kPa时,1 mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于676.7 kJ |
分析 A、根据物质的能量大小与反应热的关系来判断;
B、根据△H=生成物总能量-反应物总能量来判断;
C、一个化学反应的能量变化取决于反应物和生成物自身的性质;
D、运用盖斯定律3×②-2×①,代入数据计算可得1 mol CH3OH(g)完全燃烧生成CO2和H2O的焓变数值.
解答 解:A、上述图示中反应物的能量大于生成物的能量,应为放热反应,故A错误;
B、图示中反应物的能量大于生成物的能量,应为放热反应,能量变化△H=E1-E2,故B错误;
C、一个化学反应的能量变化取决于反应物和生成物自身的性质,与其他因素无关,CH3OH转变成H2的过程和H2燃烧能放出大量的热无关,故C错误;
D、根据①②运用盖斯定律3×②-2×①,代入数据计算可得,25℃时 H2O为液态,故放出热量大于676.7 kJ,故D正确.
故选D.
点评 本题考查化学能与热能的相互转化以及反应热的计算.注意在比较反应热大小时要带符号比较.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:解答题
| Ⅰ | Ⅱ | |
| ① | 把Fe放入稀硫酸中 | 把Fe放入稀硝酸中 |
| ② | Ca(HCO3)2溶液中加入足量的NaOH溶液 | Ca(OH)2溶液中加入足量的NaHCO3溶液 |
| ③ | 将0.1mol Cl2通入含0.3mol FeBr2的溶液中 | 将0.3mol Cl2通入含0.1mol FeBr2的溶液中 |
| ④ | 将少量SO2通入到足量氨水 | 足量SO2通入少量的氨水 |
| Ⅰ | Ⅱ | |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V正(X2)═2V逆(XY) | |
| B. | 单位时间内生成2n mol XY的同时,生n mol的Y2 | |
| C. | 容器内气体密度不随时间而变化 | |
| D. | X2、Y、XY的浓度之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com