
【题目】下列关于有机化合物M和N的说法正确的是
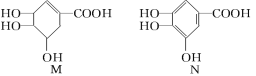
A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.N分子中,可能在同一平面上的原子最多有14个
科目:高中化学 来源: 题型:
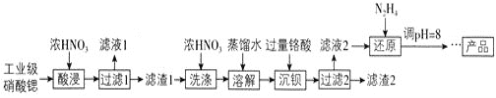
【题目】高纯硝酸锶![]() 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
已知:![]() 滤渣1的成分为
滤渣1的成分为![]() 、
、![]() ;
;![]() 铬酸
铬酸![]() 为弱酸。
为弱酸。
![]() 酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
![]() 相对于水洗,用浓硝酸洗涤的优点是___________。
相对于水洗,用浓硝酸洗涤的优点是___________。
![]() 滤液2中过量的
滤液2中过量的![]() 被
被![]() 还原为
还原为![]() ,同时放出无污染的气体,写出发生反应的离子方程式:________。
,同时放出无污染的气体,写出发生反应的离子方程式:________。
![]() 已知
已知![]() 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是![]() 结合离子方程式说明理由
结合离子方程式说明理由![]() __________。
__________。
![]() 为了测定滤渣2中
为了测定滤渣2中![]() 的含量,进行以下实验:
的含量,进行以下实验:
mg滤渣2![]() 溶液
溶液![]()
滴定终点时消耗![]() 溶液
溶液![]() 已知:
已知:![]() 。
。
![]() 滤渣2中
滤渣2中![]() 摩尔质量为
摩尔质量为![]() 的质量分数为___________
的质量分数为___________![]() 用代数式表示
用代数式表示![]() 。
。
![]() 若加入的HI溶液过量太多,测定结果会_________
若加入的HI溶液过量太多,测定结果会_________![]() “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+3Y2(g)![]() 2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
A.c(Z)=0.5 mol·L-1B.c(Y2)=0.5 mol·L-1
C.c(X2)=0.2 mol·L-1D.c(Y2)=0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如下图所示:

己知:①![]() ;
;
②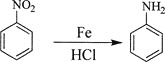
回答下列问题:
(1)A的名称是________,I含有官能团的名称是________。
(2)反应⑦的作用是________,⑩的反应类型是________。
(3)写出反应②的化学方程式:____________________________________________________。
(4)D分子中最多有________个原子共平面。E的结构简式为________。
(5)写出一种同时符合下列条件的F的同分异构体的结构简式:________。
①苯环上只有两种不同化学环境的氢原子;
②既能与银氨溶液反应又能与NaOH溶液反应。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
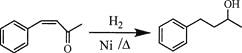 ________(无机试剂及溶剂任选)。
________(无机试剂及溶剂任选)。
合成路线流程图示例如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)![]() C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5s的平均速率v(A)=0.15 mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的分解率大于80%
D.相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C反应达到平衡前反应速率v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中,可逆反应:A(g) + B(g) xC(g)符合图中(Ⅰ)所示关系,φ(C)表示C气体在混合气体中的体积分数.由此判断,对图象(Ⅱ)说法不正确的是( )

A.p3>p4,Y轴表示A的转化率
B.p3>p4,Y轴表示B的质量分数
C.p3>p4,Y轴表示B的转化率
D.p3>p4,Y轴表示混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L。下列各组混合烃中不符合此条件的是( )
A.CH4 C2H4B.CH4 C3H6
C.C2H4 C3H4D.C2H4 CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴,并制备金属锂。
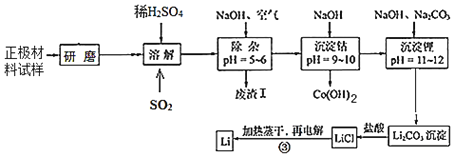
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)LiCoO2中,Co元素的化合价为_____。
(2)上述流程中为加快化学反应速率而采取的措施是_____。
(3)在上述溶解过程中,通入SO2的目的为_____。
(4)加NaOH调pH的目的是_____。
(5)写出“沉钴”过程中发生反应的离子方程式_____。
(6)洗涤所得Li2CO3沉淀要使用_____(填“热水”或“冷水”),将氯化锂溶液蒸干的过程中还需不断通入HCl气体,其作用是_____。
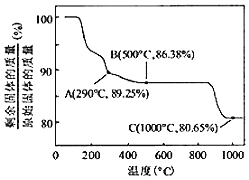
(7)Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA
B. 1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA
C. 生成1mol还原产物时转移电子数为8NA
D. 通常状况下,11.2L.CO2中含有的共价键数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com