
【题目】碳酸二乙酯(![]() )常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
)常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
化学式 | 熔点/℃ | 沸点/℃ | 物理性质 |
COCl2 | -118 | 8.2 | 微溶于水,溶于芳烃、苯、四氯化碳、氯仿、乙酸等多数有机溶剂,遇水迅速水解,生成氯化氢 |
SO3 | 16.8 | 44.8 | 溶于水,并与水反应生成硫酸和放出大量的热 |
SO2Cl2 | -54.1 | 69.1 | 溶于乙酸、苯,与水反应生成H2SO4和HCl |
CCl4 | -22.9 | 76.8 | 微溶于水,易溶于多数有机溶剂 |
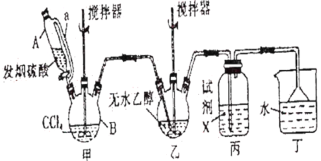
回答下列问题:
(1)甲装置主要用于制备光气(COCl2),先将仪器B中的四氯化碳加热至55~60℃,再缓缓滴加发烟硫酸。
①仪器B的名称是__________。
②仪器A的侧导管a的作用是__________。
(2)试剂X是__________,其作用是__________。
(3)丁装置除了吸收COCl2外,还能吸收的气体是__________(填化学式)。仪器B中四氯化碳与发烟硫酸(用SO3表示)反应只生成两种物质的量为1:1的产物,且均易与水反应,写出该反应化学方程式:__________。
(4)无水乙醇与光气反应生成氯甲酸乙酯,再继续与乙醇反应生成碳酸二乙酯。
①写出无水乙醇与光气反应生成氯甲酸乙酯的化学方程式:__________。
②若起始投入92.0g无水乙醇,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是__________(三位有效数字)
【答案】三颈烧瓶 平衡压强,有利于仪器A中液体顺利流下 浓硫酸 防止丁装置中的水蒸气进入乙中 HC1 SO3+CCl4![]() COCl2+SO2Cl2 COCl2+CH3CH2OH→CH3CH2OOCCl+HCl 80.0%
COCl2+SO2Cl2 COCl2+CH3CH2OH→CH3CH2OOCCl+HCl 80.0%
【解析】
甲装置主要用于制备光气(COCl2),仪器B中四氯化碳与发烟硫酸(用SO3表示)反应只生成两种物质的量为1:1的产物,且均易与水反应,所以四氯化碳与SO3反应生成COCl2和SO2Cl2,COCl2在装置乙中与无水乙醇反应生成碳酸二乙酯,COCl2易水解,为防止水蒸气进入乙,丙装置中盛放浓硫酸。
(1)①根据图示,仪器B的名称是三颈烧瓶;
②仪器A是恒压漏斗,侧导管a的作用是平衡压强,有利于仪器A中液体顺利流下;
(2) COCl2易水解,为防止丁装置中的水蒸气进入乙中,试剂X应是浓硫酸;
(3)乙装置中COCl2、乙醇反应生成碳酸二乙酯和氯化氢,丁装置除了吸收COCl2外,还能吸收的气体是HCl。仪器B中四氯化碳与SO3反应生成COCl2和SO2Cl2,该反应化学方程式是SO3+CCl4![]() COCl2+SO2Cl2;
COCl2+SO2Cl2;
(4)①无水乙醇与COCl2反应生成氯甲酸乙酯和氯化氢,反应的化学方程式是COCl2+CH3CH2OH→CH3CH2OOCCl+HCl;
②2mol乙醇和光气反应生成1mol碳酸二乙酯,若起始投入92.0g无水乙醇,理论上生成碳酸二乙酯的质量是![]() ,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是
,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是![]() 。
。


科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为1L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列表述中正确的是( )
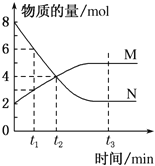
A.该反应的化学方程式为2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用下列10种物质的序号填空:①O2②H2③NH4NO3④K2O2⑤Ba(OH)2⑥CH4⑦CO2⑧NaF ⑨NH3⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是____________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
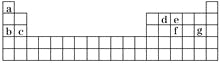
①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
A.c和f | B.b和g | C.d和g | D.b和e |
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4.FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
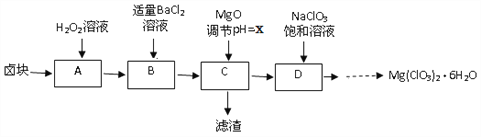
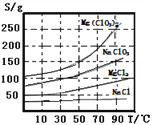
已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
②室温时一些物质的Ksp如下表:
化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
③Mg(ClO3)2有较强的氧化性,其还原产物是Cl-.
(1)H2O2的电子式为_________
(2)滤渣的成分是____________(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为______
(4)D中所发生的化学反应方程式为_____,框图中由D→......→制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②_______(请补充);③冷却结晶;④过滤洗涤。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式____________
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果_____(填“偏大”. “偏小”或“不变”)。
③若平均消耗K2Cr2O7溶液15.00 mL,则产品中Mg(ClO3)2·6H2O(其M=299g/mol)的质量分数为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC-COOH)俗称草酸。草酸晶体的化学式为H2C2O4·2H2O,草酸在100℃时开始升华,157℃时大量升华,并开始分解产生CO、CO2和H2O,草酸蒸气在低温下可冷凝为固体;草酸是一种二元弱酸但酸性比碳酸强,具有还原性能使酸性高锰酸钾溶液褪色,草酸钙难溶于水,回答下列问题:
(1)写出草酸晶体受热分解的化学方程式___。
(2)可用下列装罝验证草酸晶体的分解产物(草酸晶体分解装置、夹待装置及连接导管均略去)。

①装置的连接顺序为:___、___DEDE___、___。
②A装置的作用是___,检验产物中有CO的实验现象是___。
③写出整套装置存在不合理之处___。
(3)下列叙述能说明草酸具有弱酸性的是___。
a.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
b.测定草酸钠(Na2C2O4)溶液的pH
c.等体积等浓度的草酸溶液和稀硫酸,稀硫酸消耗碱的能力强
d.pH=2的草酸溶液和稀硫酸,分别稀释100倍后前者pH小
e.将草酸晶体加入Na2CO3溶液中,有CO2放出
(4)已知:NH3·H2ONH4++OH-,Kb=1.85×10-5
H2C2O4H++HC2O4-,Ka1=5.4×10-2
HC2O4-H++C2O42-,Ka2=5.4×10-5
则(NH4)2C2O4溶液的pH___7(填“>”或“<”或“=”)。
(5)可用0.10mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液。
①确定过程中发生反成的离子方程式为___;
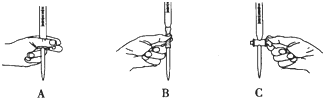
②滴定过程中操作滴定管的图示正确的是___。
③每次准确量取25.00mL草酸溶液,滴定三次分别消耗0.10mol/L酸性KMnO4标准溶液的体积是20.00mL、19.80mL、20.20mL,则该草酸溶液的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是( )
A.16gO2与O3的混合气体中含有的原子数为NA
B.100g46%的乙醇(C2H5OH)溶液共含氢原子数6NA
C.7.8gNa2O2含有的离子数为0.4NA
D.0.1molFe在足量氧气中燃烧,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+3B(g)![]() 2C(g)△H<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是( )
2C(g)△H<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是( )
A.甲中达平衡时,用B的浓度变化表示5min内的平均反应速率为0.15 molL-1min-1
B.乙中的热化学方程式为2C(g)![]() A(g)+3B(g):△H=+4/3Q2 kJ/mol
A(g)+3B(g):△H=+4/3Q2 kJ/mol
C.乙中达到平衡后,再加入0.25molA、0.75molB、1.5molC,与原平衡互为等效平衡,平衡不移动
D.乙中平衡时C的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果与图像相符的是( )
A.向含有盐酸、氯化镁和氯化铝的溶液中逐滴加入NaOH溶液直至过量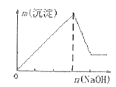
B.向澄清石灰水中通入CO2气体直至过量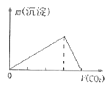
C.向NaAlO2溶液中逐滴加入盐酸直至过量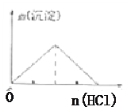
D.向AlCl3溶液中逐滴加入氨水直至过量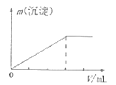
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中列出了25C、101kPa时一些物质的燃烧热数据
物质 | CH4 | C2H2 | H2 |
燃烧热/( kJ·mol-1) | 890.3 | 1299.6 | 285.8 |
已知键能:C—H键:413.4 kJ·mol-1、H—H键:436 kJ·mol-1,乙炔的结构是为H—C![]() C—H则下列叙述正确的是( )
C—H则下列叙述正确的是( )
A.2H2(g) + 2O2(g) = 2H2O(g) ΔH = -571.6 kJ·mol-1
B.CH4和C2H2中所含化学键完全相同
C.2CH4(g) = C2H2(g) + 3H2(g) ΔH = -376.4 kJ·mol-1
D.C![]() C键能为796 kJ·mol-1
C键能为796 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com