
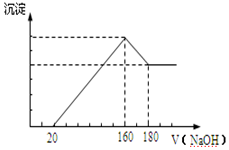
| A. | 若ρ(甲)<ρ(乙),则气体的压强:甲>乙 | B. | 若ρ(甲)>ρ(乙),则分子数:甲>乙 | ||
| C. | 若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙 | D. | 若ρ(甲)>ρ(乙),则气体体积:甲<乙 |
分析 两种气体的物质的量、摩尔质量相同,根据m=nM可知两种气体的质量相同,
A.若ρ(甲)<ρ(乙),根据V=$\frac{m}{ρ}$可知容器容积V:甲>乙,结合气体物质的量相等分析压强;
B.根据N=nNA知,分子数与物质的量成正比;
C.若ρ(甲)<ρ(乙),根据V=$\frac{m}{ρ}$可知容器容积V:甲>乙,根据Vm=$\frac{V}{n}$分析气体摩尔体积;
D.若ρ(甲)>ρ(乙),根据V=$\frac{m}{ρ}$可知分析容器容积V.
解答 解:两种气体的物质的量、摩尔质量相同,根据m=nM可知两种气体的质量相同,
A.若ρ(甲)<ρ(乙),根据V=$\frac{m}{ρ}$可知容器容积V:甲>乙,由于气体物质的量相等,容器体积越大压强越小,则气体的压强:甲<乙,故A错误;
B.根据N=nNA知,分子数与物质的量成正比,二者的物质的量相等,所以其分子数相等,故B错误;
C.若ρ(甲)<ρ(乙),则V=$\frac{m}{ρ}$可知容器容积V:甲>乙,根据Vm=$\frac{V}{n}$可知气体摩尔体积:甲>乙,故C错误;
D.若ρ(甲)>ρ(乙),则V=$\frac{m}{ρ}$可知分析容器容积V:甲<乙,故D正确;
故选D.
点评 本题考查了阿伏伽德罗定律及推论,题目难度中等,明确阿伏伽德罗定律内容及推理为解答关键,试题有利于提高学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题:
已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题: ,A与C形成的10电子分子的电子式为
,A与C形成的10电子分子的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第VA族 | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | 原子半径大小顺序为X>T>Y | |
| D. | Z元素的最高价氧化物对应的水化的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 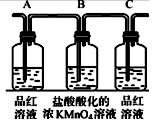 |  |  | 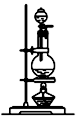 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com