
| A. | 浓度均为0.1 mol•L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) | |
| B. | 浓度均为0.1 mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) | |
| C. | 等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 | |
| D. | 在0.1 mol•L-1NaA溶液中各离子浓度关系为:c(Na+)>c(A一)>c(OH一)>c(H+) |
分析 弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB),则酸性HA>HB,等浓度时,HA电离程度较大,溶液c(H+)较大,对应的NaA、NaB中,NaB易水解,以此解答该题.
解答 解:弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB),则HA酸性较强,
A.等温、浓度均为0.1mol•L-1的HA、HB溶液中,HA的c(H+)较大,pH较小,故A错误;
B.NaB易水解,等温浓度均为0.1mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)<pH(NaB),故B错误;
C.等体积pH相同的HA、HB溶液,因HB较弱,则HB浓度较大,物质的量较多,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB少,故C错误;
D.NaA为强碱弱酸盐,水解呈碱性,溶液中离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),故D正确.
故选D.
点评 本题考查了弱电解质的电离,侧重于学生的分析能力的考查,明确电离平衡常数与酸性强弱、酸根离子水解程度大小之间的关系是解本题关键,题目难度不大.


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:填空题
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1 )一定温度下,在2L的密闭容器中,SO2、O2、SO3三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题:
)一定温度下,在2L的密闭容器中,SO2、O2、SO3三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题:
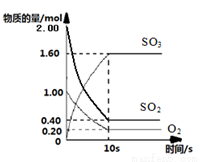
①反应的化学方程式为
②反应开始到10s,用SO2表示的反应速率为
③O2的平衡转化率为
(2)对于反应:2SO2(g)+O2(g) 2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
(3)已知:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH=-113.0kJ·mol-1
2NO2(g)ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g)  SO3(g)+NO(g)的ΔH=_________kJ·mol-1。
SO3(g)+NO(g)的ΔH=_________kJ·mol-1。
(4)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
下列说法中不正确的是
A.物质的量是一个物理量,物质的量的单位是摩尔
B.2 mol水的摩尔质量是1 mol水的摩尔质量的2倍
C.N2、CO组成的混合气体28g,其物质的量为1mol
D.标准状况下, 2L二氧化碳和3L一氧化碳所含有的原子数目相等.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室配制480mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制480mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1××10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | |
| B. | 一定大于0.1 mol•L-1 | |
| C. | 若为强酸一定等于0.1 mol•L-1,若为弱酸一定小于0.1 mol•L-1 | |
| D. | 若为强酸一定≤0.1 mol•L-1,若为弱酸一定>0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶洗净后还留有蒸馏水 | |
| B. | 取碱液的滴定管开始有气泡,放出液体后气泡消失 | |
| C. | 溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液无变化 | |
| D. | 用碱式滴定管取一定体积的NaOH溶液时,量取前仰视读数,量取后俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气混合后光照发生反应 | B. | 乙炔和氯气的加成反应 | ||
| C. | 甲苯与等物质的量的Br2发生反应 | D. | 乙烯与水的加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com