
 -C≡C-CH=CH-CH3,有关其结构说法正确的是( )
-C≡C-CH=CH-CH3,有关其结构说法正确的是( )| A. | 所有碳原子不可能在同一平面上 | B. | 所有碳原子可能在同一条直线上 | ||
| C. | 碳原子同一平面上至少有9个 | D. | 所有原子可能在同一平面上 |
分析 根据共面结构的基本物质:乙烯、乙炔、苯环等的结构来回答,乙烯为平面形,苯为平面形,乙炔为直线形,也在同一平面上.
解答 解:A.有机物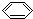 -C≡C-CH=CH-CH3中,具有苯环、乙烯的共面结构以及乙炔的共线结构,所以苯环的6个碳原子一定共面,具有乙烯结构的后4个碳原子一定共面,具有乙炔结构的两个碳原子(倒数第四个和倒数第五个)一定共线,所有的碳原子可以共面,故A错误;
-C≡C-CH=CH-CH3中,具有苯环、乙烯的共面结构以及乙炔的共线结构,所以苯环的6个碳原子一定共面,具有乙烯结构的后4个碳原子一定共面,具有乙炔结构的两个碳原子(倒数第四个和倒数第五个)一定共线,所有的碳原子可以共面,故A错误;
B.炔烃中两个碳乙基炔烃相连的乙烯基中1个碳可以共平面,另外乙基与此取代基处于对位上,故与乙基相连的苯环上的C和乙基山1个碳也与其共直线,故总共可以有6个碳原子共直线,故B错误;
C.苯为平面结构,乙炔为直线型分子,取代乙炔分子中氢原子的位置在同一直线上,碳原子同一平面上至少有9个,故C正确;
D.甲烷是正四面体结构,与碳原子相连的四个原子不可能在同一平面上,故D错误.
故选C.
点评 本题主要考查有机物的基本结构知识,难度不大,注意甲烷是正四面体结构,与碳原子相连的四个原子不可能在同一平面上.


科目:高中化学 来源: 题型:解答题
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/L KMnO4溶液 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同, 进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
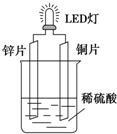 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:| 实验后的记录: ①Zn片发生还原反应,Cu片发生氧化反应 ②H+向负极移动 ③LED发光时,电子流动方向Zn→导线→Cu,再经溶液流回铜片 ④溶液的pH变小 ⑤若有1mol电子流过导线,则产生H2为0.5mol. ⑥装置中存在“化学能→电能→光能”的转换 |
| 序号 | 甲 | 乙 | 丙 |
| 装置 | 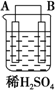 | 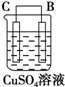 | 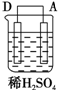 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 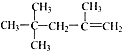 2,2,4-三甲基一4 一戊烯 2,2,4-三甲基一4 一戊烯 | |
| B. |  l,3,4一三甲苯 l,3,4一三甲苯 | |
| C. | CH3CH(CH3)CH(OH)CH3 2-甲基-3-丁醇 | |
| D. |  3,3,4-三甲基己烷 3,3,4-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m:n:w=3:1:2 | |
| B. | 体积和温度不变时,若在前10s内A减少了x mol,则B在前20s内减少$\frac{2x}{3}$ mol | |
| C. | 体积和温度不变时,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 | |
| D. | 单位时间内反应物浓度的减少大于生成物浓度的增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研制水溶剂涂料替代有机溶剂涂料 | |
| B. | 用可降解塑料生产包装盒或快餐盒 | |
| C. | 用反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O 制备硫酸铜 | |
| D. | 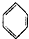 +CH2=CH2→ +CH2=CH2→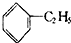 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
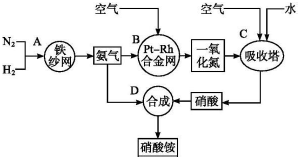
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能呈酸性 | B. | 不可能呈碱性 | ||
| C. | 可能呈中性或碱性 | D. | 不可能呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com