
| A. | 浓硫酸具有脱水性,因此实验室可用浓硫酸与浓盐酸制取少量HCl气体 | |
| B. | 钠是活泼金属,可用电解NaCl溶液的方法获得金属钠 | |
| C. | 碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 | |
| D. | 在电热水器的钢铁内胆中装入铜棒可以防止内胆被腐蚀 |
分析 A.浓硫酸和浓盐酸制取少量氯化氢是利用浓硫酸的吸水性和浓盐酸的挥发性;
B.钠是活泼金属,应该用电解熔融氯化钠的方法冶炼Na;
C.碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,碱性溶液能促进油脂水解;
D.作原电池正极的金属被保护.
解答 解:A.浓硫酸和浓盐酸制取少量氯化氢是利用浓硫酸的吸水性和浓盐酸的挥发性,浓硫酸吸收浓盐酸中的水分而促进浓盐酸挥发,故A错误;
B.钠是活泼金属,应该用电解熔融氯化钠的方法冶炼Na,如果电解氯化钠溶液,阴极上氢离子放电而不是钠离子放电,所以得不到Na单质,故B错误;
C.碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,且碳酸钠水解是吸热反应,升高温度促进碳酸钠水解,碱性溶液能促进油脂水解,所以用热的碳酸钠溶液洗涤油污,故C正确;
D.铁、铜和合适的电解质溶液构成原电池,铁作负极,铜作正极,所以构成的原电池能加快铁的腐蚀,故D错误;
故选C.
点评 本题考查知识点较综合,涉及盐类水解、原电池原理、金属冶炼、浓硫酸的性质,为高频考点,侧重考查学生综合知识灵活运用能力,明确金属活泼性与冶炼方法的关系、盐类水解特点、原电池原理等知识点是解本题关键,易错选项是B,注意浓硫酸吸水性和脱水性区别.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是SO3气体 |
| B | 向某溶液中加入Cu 和浓H2SO4 | 试管口有红棕色气体产生 | 原溶液可能含有NO3- |
| C | 将Na投到一定浓度的CuCl2溶液 | 出现气泡并有固体生成 | Na与CuCl2溶液反应,有H2和Cu生成 |
| D | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸可使紫色石蕊试液变红色 | |
| B. | 二氧化硫通入紫色石蕊试液中.试液先变红后褪色 | |
| C. | 可用锌粒与稀硝酸反应制备氢气 | |
| D. | 液溴易挥发,所以存放液溴的试剂瓶中应加水封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.3 0 | 0.36 | 0.36 |
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3是反应的还原剂 | |
| B. | Na2O2既是氧化剂又是还原剂 | |
| C. | Na2FeO4是反应的氧化产物 | |
| D. | 氧化剂与还原剂的物质的量的比是3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
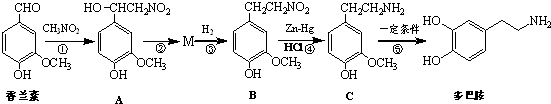
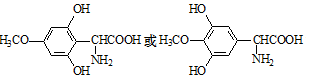 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2水,NaOH(aq) | B. | KMnO4(aq),氨水 | C. | H2O2溶液,氧化铜 | D. | HNO3(aq),氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com