
 已知A、B、C、D、E五种元素是周期表中前四周期元素.且原子序数依次增大. 其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子. D、E 为同周期元素且分别位于s区和d区.五种元素所有的s能均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.
已知A、B、C、D、E五种元素是周期表中前四周期元素.且原子序数依次增大. 其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子. D、E 为同周期元素且分别位于s区和d区.五种元素所有的s能均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和. .
.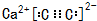 ,若细胞的长宽高分別为520pm、520pm和690pm,该晶体密度为2.28 g•cn-2(保留到小数点后两位).
,若细胞的长宽高分別为520pm、520pm和690pm,该晶体密度为2.28 g•cn-2(保留到小数点后两位). 分析 A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,三元素处于短周期,且B、C原子中均有两个未成对电子,二者外围电子数排布分别为ns22p2、ns22p4,结合A为非金属元素,可知A为硼元素、B为碳元素、C为O元素;D、E为同周期元素且分别位于s区和d区,则二者处于第四周期,五种元素所有的s能级电子均为全充满,则D为Ca;E的d能级电子数等于A、B、C最高能层的p能级电子数之和,则E的d能级电子数为1+2+4=7,即E的外围电子排布为3d74s2,故E为Co.
(1)非金属性越强电负性越大,同周期自左而右电负性增大;
(2)E为Fe,Fe2+离子的价电子排布式为3d6,根据泡利原理、洪特规则画出价电子排布图;,
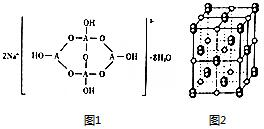
(3)①A为B原子,结构中B原子形成3个单键、4个单键(含有1个配位键),B原子核外最外层的3个电子全部参与成键;
②形成4个键的B原子中含有1个配位键,氢氧根离子中氧原子与B原子之间形成配位键;该阴离子通过氢键相互结合形成链状结构;
③H3AO3为一元弱酸,与水形成配位键,电离出[A(OH)4]-与氢离子;
(4)N元素电负性更小,更易给出孤对电子形成配位键,[Fe(NH3)6]2+的立体构型为正八面体,
(5)由元素C、Ca组成的某离子化合物为CaC2,属于离子化合物,C22-离子中碳原子之间形成3对共用电子对;
晶胞中钙离子、C22-数目相等,根据均摊法计算晶胞中钙离子、C22-数目数目,再计算晶胞质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,三元素处于短周期,且B、C原子中均有两个未成对电子,二者外围电子数排布分别为ns22p2、ns22p4,结合A为非金属元素,可知A为硼元素、B为碳元素、C为O元素;D、E为同周期元素且分别位于s区和d区,则二者处于第四周期,五种元素所有的s能级电子均为全充满,则D为Ca;E的d能级电子数等于A、B、C最高能层的p能级电子数之和,则E的d能级电子数为1+2+4=7,即E的外围电子排布为3d74s2,故E为Co.
(1)非金属性越强电负性越大,同周期自左而右电负性增大,五种元素中,O元素电负性最大,
故答案为:O;
(2)E为Co,Co2+离子的价电子排布图 ,
,
故答案为: ;
;
(3)①A为B原子,结构中B原子形成3个单键、4个单键(含有1个配位键),B原子核外最外层的3个电子全部参与成键,杂化杂化轨道类型为sp2、sp3,
故答案为:sp2、sp3;
②形成4个键的B原子中含有1个配位键,氢氧根离子中氧原子与B原子之间形成配位键,图1中用“→”标出其中的配位键为: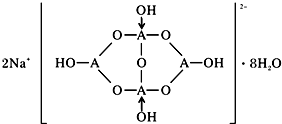 ,该阴离子通过氢键相互结合形成链状结构,
,该阴离子通过氢键相互结合形成链状结构,
故答案为: ;氢键;
;氢键;
③H3AO3为一元弱酸,与水形成配位键,电离出[A(OH)4]-与氢离子,用离子方程式解释分析H3BO3为一元酸的原因:H3BO3+H2O?[B(OH)4]-+H+,
故答案为:H3BO3+H2O?[B(OH)4]-+H+;
(4)Fe2+离子在水溶液中以[Fe(H2O)6]2+形式存在,向含Fe2+离子的溶液中加入氨水,可生成更稳定的[Fe(NH3)6]2+离子,其原因是:N元素电负性更小,更易给出孤对电子形成配位键,[Fe(NH3)6]2+的立体构型为正八面体,
故答案为:N元素电负性更小,更易给出孤对电子形成配位键;正八面体;
(5)由元素C、Ca组成的某离子化合物为CaC2,该物质的电子式为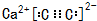 ,
,
晶胞中钙离子、C22-数目相等,C22-数目数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{64}{6.02×1{0}^{23}}$g,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为4×$\frac{64}{6.02×1{0}^{23}}$g÷(520×10-10cm×520×10-10cm×690×10-10cm)=2.28g/cm3,
故答案为: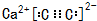 ;2.28.
;2.28.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、杂化方式、微粒结构、配位键、晶胞计算等,推断元素是解题关键,侧重考查学生分析推理能力、知识迁移运用能力,需要学生具备扎实的基础.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
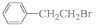 与过量NaOH醇溶液共热时发生了消去反应的是( )
与过量NaOH醇溶液共热时发生了消去反应的是( )| A. | 混合体系$\stackrel{溴水}{→}$Br2的颜色褪去 | |
| B. | 混合体系$\stackrel{足量稀HNO_{3}}{→}$ $\stackrel{AgNO_{3}溶液}{→}$淡黄色沉淀 | |
| C. | 混合体系$\stackrel{提取}{→}$有机物$\stackrel{酸性KMnO_{4}溶液}{→}$紫色褪去 | |
| D. | 混合体系$\stackrel{提取}{→}$有机物$\stackrel{Br_{2}的CCl_{4}溶液}{→}$Br2的颜色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,22g CO2含碳氧双键数目为2 NA | |
| B. | 12.0g NaHSO4固体中含阳离子数目为0.1 NA | |
| C. | 标准状况下,22.4 L Br2中所含分子数为NA | |
| D. | 7.8 g Na202与足量的水反应转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性 | B. | 最高价氧化物对应水化物的酸性 | ||
| C. | 单质与氢气反应的难易 | D. | 单质与氢气反应放出热量的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 | |
| B. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| C. | 用溴的四氯化碳溶液吸收SO2气体 | |
| D. | 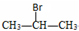 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲、乙两烧杯中水电离出OH-浓度:甲<乙 | |
| B. | 分别稀释相同倍数,溶液pH变化:甲=乙 | |
| C. | 相同条件,AgCl(s)在甲中溶解度大于在乙中 | |
| D. | 向乙烧杯加入l0.0mL 0.1mol/L NaOH溶液后一定存在:c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
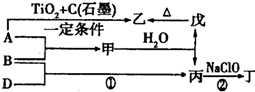
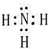 ,丁中所包含的化学键类型有bc(填字母序号).
,丁中所包含的化学键类型有bc(填字母序号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com