
【题目】实验室模拟合成硫酸的流程如下:

从下图中选择制取气体的合适装置:

(1)装置C的名称为_________________,实验室通常能用装置C制备_________。
A.H2 B.H2S C.CO2 D.O2
(2)实验室用装置D制备NH3的化学方程式为_______________________________。
(3)若用装置B制备SO2,可以选用试剂为___________。
A、浓硫酸、亚硫酸钠固体 B.浓硫酸、铜片
C.稀硫酸、亚硫酸溶液 D.浓硫酸、铁屑
(4)SO2和O2通过甲装置,甲装置的作用除了可以控制SO2、O2的流速外,还可以__________。

(5)若将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
表中x=_______mol,y=_______mol,T1______T2(填“>”、“=”或“<”)
(6)SO2尾气可用NaOH溶液吸收,得到Na2SO3和NaHSO3两种盐。若一定物质的量的SO2与氢氧化钠溶液反应,所得溶液中Na2SO3和NaHSO3的物质的量之比为2:3,则参加反应的SO2和NaOH的物质的量之比为________。
A. 5:7 B.1:2 C.9:4 D.9:13
(7)硫酸与氨水反应生成硫酸铵或硫酸氢铵,现称取(NH4)2SO4和NH4HSO4混合物样品7.58 g,加入含0.1 molNaOH的溶液,发生反应:①OH-+H+→H2O, ②OH-+NH4+→NH3↑+H2O。充分反应,生成1792 mL(标准状况)。已知①优先反应,则样品中(NH4)2SO4的物质的量为_______mol,NH4HSO4的物质的量为_______mol。
【答案】 启普发生器 ABC 2NH4Cl + Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O A 干燥气体、充分混合气体 1.6 0.2 > A 0.04 0.02
CaCl2+ 2NH3↑+ 2H2O A 干燥气体、充分混合气体 1.6 0.2 > A 0.04 0.02
【解析】考查实验方案设计与评价,(1)装置C的名称为启普发生器;启普发生器用于固体与液体反应不加热制备气体,固体要求反应前后始终保持块状,且此反应放出热量少,因此可以制备气体是H2、H2S、CO2等,故选项ABC正确;(2)实验室制备氨气,用NH4Cl和Ca(OH)2受热制备,反应方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;(3)装置B制备SO2,利用不需要加热来制备,即NaHSO3和浓硫酸的反应,铜片和浓硫酸反应需要加热,铁和浓硫酸发生钝化反应,稀硫酸与亚硫酸不产生二氧化硫,故A正确;(4)浓硫酸具有吸水性,可以干燥SO2和O2,使SO2和O2充分混合;(5)发生2SO2+O2
CaCl2+2NH3↑+2H2O;(3)装置B制备SO2,利用不需要加热来制备,即NaHSO3和浓硫酸的反应,铜片和浓硫酸反应需要加热,铁和浓硫酸发生钝化反应,稀硫酸与亚硫酸不产生二氧化硫,故A正确;(4)浓硫酸具有吸水性,可以干燥SO2和O2,使SO2和O2充分混合;(5)发生2SO2+O2![]() 2SO3,达到平衡时,消耗O2的物质的量为(2-0.8)mol=1.2mol,即消耗SO2的物质的量为2.4mol,x=(4-2.4)mol=1.6mol,消耗SO2为(4-0.4) mol=3.6mol,则消耗氧气的物质的量为3.6/2mol=1.8mol,y=(2-1.8)mol=0.2mol,SO2与氧气反应是放热反应,升高温度促使平衡向逆反应方向进行,根据表格数据,应是T1>T2;(6)根据元素守恒,Na的物质的量等于NaOH物质的量,即n(NaOH)=(2×2+3)mol=7mol,SO2的物质的量n(SO2)=(2+3)mol=5mol,即SO2和NaOH物质的量比值为7:5,故A正确;(7)因为优先发生中和反应,因此设NH4HSO4的物质的量为xmol,因为有氨气产生,因此H+完全反应,溶液中含有(0.1-x)mol的OH-,再与NH4+反应,NH4++OH-=NH3↑+H2O,因此有0.1-x=1792×10-3/22.4mol,解得x=0.02mol,即(NH4)2SO4的物质的量为(7.58-0.02×115)/132mol=0.04mol。
2SO3,达到平衡时,消耗O2的物质的量为(2-0.8)mol=1.2mol,即消耗SO2的物质的量为2.4mol,x=(4-2.4)mol=1.6mol,消耗SO2为(4-0.4) mol=3.6mol,则消耗氧气的物质的量为3.6/2mol=1.8mol,y=(2-1.8)mol=0.2mol,SO2与氧气反应是放热反应,升高温度促使平衡向逆反应方向进行,根据表格数据,应是T1>T2;(6)根据元素守恒,Na的物质的量等于NaOH物质的量,即n(NaOH)=(2×2+3)mol=7mol,SO2的物质的量n(SO2)=(2+3)mol=5mol,即SO2和NaOH物质的量比值为7:5,故A正确;(7)因为优先发生中和反应,因此设NH4HSO4的物质的量为xmol,因为有氨气产生,因此H+完全反应,溶液中含有(0.1-x)mol的OH-,再与NH4+反应,NH4++OH-=NH3↑+H2O,因此有0.1-x=1792×10-3/22.4mol,解得x=0.02mol,即(NH4)2SO4的物质的量为(7.58-0.02×115)/132mol=0.04mol。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列化学用语中,正确的是
A. NH4+的水解反应离子方程式:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
B. 在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-=AgI↓
C. 镀铜时,阳极的电极反应式为:Cu2++2e-═Cu
D. 某反应△H<0,则该反应在任意条件下均可自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是( )
A.Na+、K+、OH﹣、Cl﹣
B.Na+、Cu2+、SO42﹣、NO3﹣
C.Mg2+、Na+、SO42﹣、Cl﹣
D.K+、Na+、NO3﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
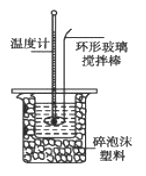
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):_____________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:______。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是________。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:

①由图1可知SCR技术中的氧化剂为________。
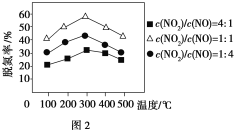
②用Fe作催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)=________。
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO![]() ,SO
,SO![]() 可以被海水中的溶解氧氧化为SO
可以被海水中的溶解氧氧化为SO![]() 。海水的pH会________(填“升高”“不变”或“降低”)。
。海水的pH会________(填“升高”“不变”或“降低”)。
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是_____________________。
(4)碲(Te)为第ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是___________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的甲烷燃烧后得到的产物为CO、CO 2 和水蒸气,此混合气体质量为 49.6 g ,当其缓慢经过无水氯化钙(足量)时,氯化钙增重 25.2 g ,则原混合气体中CO 的质量为( )
A. 26.4 g B. 19.7 g C. 13.2 g D. 11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某+2价离子的电子排布式为1s22s22p63s23p63d9,该元素在周期表中所属的族是( )
A. IIA B. IIB C. VIII D. IB
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com