
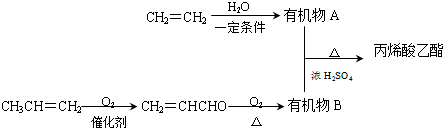
 ��
�� ���� CH2=CH2��ˮ�����ӳɷ�Ӧ������AΪCH3CH2OH����ϩ����������Ӧ���ɱ�ϩȩ��CH2=CHCHO����������Ӧ����BΪCH2=CHCOOH��CH2=CHCOOH��CH3CH2OH����������Ӧ���ɱ�ϩ������CH2=CHCOOCH2CH3�����ݹ����ŵ����ʺͱ仯�жϷ�Ӧ���Ͳ�д����Ӧ�Ļ�ѧ����ʽ��
��� �⣺CH2=CH2��ˮ�����ӳɷ�Ӧ������AΪCH3CH2OH����ϩ����������Ӧ���ɱ�ϩȩ��CH2=CHCHO����������Ӧ����BΪCH2=CHCOOH��CH2=CHCOOH��CH3CH2OH����������Ӧ���ɱ�ϩ������CH2=CHCOOCH2CH3��
��1����ϩȩ��CH2=CHCHO���к��еĹ�����Ϊ̼̼˫����ȩ�����ʴ�Ϊ��̼̼˫����ȩ����
��2����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ���CH2=CHCHO�Ʊ��л���B�Ļ�ѧ��Ӧ����Ϊ������Ӧ��
�ʴ�Ϊ���ӳɷ�Ӧ��������Ӧ��
��3���Ҵ���Cu�����������������·���������Ӧ������ȩ��ˮ����Ӧ����ʽΪ2CH3CH2OH+O2 $��_{��}^{Cu}$CH3CHO+2H2O��
�ʴ�Ϊ��2CH3CH2OH+O2 $��_{��}^{Cu}$CH3CHO+2H2O��
��4���۱�ϩ�ṹ��ʽΪ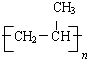 ���ʴ�Ϊ��
���ʴ�Ϊ��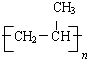 ��
��
���� ���⿼���л����ƶϣ�Ϊ��Ƶ���㣬��ȷ�����ż������ʹ�ϵ�ǽⱾ��ؼ���֪������֮���ת������Ӧ��������Ӧ���ͣ�ע��۱�ϩ����д������Ϊ�״��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 12.8g | B�� | 9.6g | C�� | 6.4g | D�� | 3.2g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2�� | B�� | 3�� | C�� | 4�� | D�� | 5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.02 mol | B�� | 0.01 mol | C�� | 0.04 mol | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
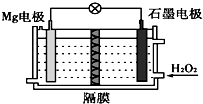
| A�� | Mg �缫�Ǹõ�ص����� | B�� | H2O2 ��ʯī�缫�Ϸ���������Ӧ | ||
| C�� | ʯī�缫������Һ��pH ���� | D�� | ��Һ��Cl-�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
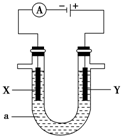 ���ԭ���ڻ�ѧ��ҵ�����Ź㷺��Ӧ�ã��ֽ���Ƶ�ԭ���ͨ����������ͼ�е������������У�aΪ�������Һ��X��Y������缫�壬��
���ԭ���ڻ�ѧ��ҵ�����Ź㷺��Ӧ�ã��ֽ���Ƶ�ԭ���ͨ����������ͼ�е������������У�aΪ�������Һ��X��Y������缫�壬���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״����11.2 L���麬��2NA�����ۼ� | |
| B�� | 4.8 g Mg��������Ӧ�õ�������Ϊ0.4 NA�� | |
| C�� | 0.1 mol•L-1������������Һ�к���������Ϊ0.1NA�� | |
| D�� | 5.6 g����������ϡ���ᷴӦʧȥ������Ϊ0.3NA�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com