
| A. | 容量瓶、分液漏斗、滴定管在使用前都需要检查是否漏水,可以用相同的实验方法检查是否漏水 | |
| B. | 溶液蒸发操作时蒸发皿中液体的量不能超过容积的$\frac{1}{2}$ | |
| C. | 强酸滴定强碱时,用酚酞指示剂比用甲基橙更易判断滴定终点 | |
| D. | 将灼烧后的海带灰加水煮沸2-3分钟的目的是加快碘化物在水中的溶解,使灰烬中的碘离子尽可能多的进入溶液 |
分析 A.根据带有旋塞和瓶塞的仪器,一般在使用前需要检查是否漏水,容量瓶和分液漏斗都需要检查瓶塞是否漏水,而酸式滴定管和碱式滴定管下端不同,二者的查漏方法与容量瓶和分液漏斗的方法不同;
B.蒸发时,加入的液体不能超过容器容积的$\frac{2}{3}$;
C.酚酞:酸滴定碱时:颜色由红刚好褪色;甲基橙:酸滴定碱时:颜色由黄到橙色;
D.海带中碘元素的分离实验中,在灼烧后的海带灰中加入蒸馏水,煮沸2~3min,再过滤,得到滤液,煮沸的目的是为了加快碘化物在水中的溶解,以使灰烬中的碘离子尽可能多的进入溶液.
解答 解:A.容量瓶、分液漏斗、滴定管是带有旋塞和瓶塞的仪器,使用前都需要检查是否漏水,但酸式滴定管和碱式滴定管下端不同构造不同,查漏方法与分液漏斗、容量瓶的查漏方法不同,故A错误;
B.蒸发时,加入的液体不能超过容器容积的$\frac{2}{3}$,过多液体可能溢出,故B错误;
C.酚酞:酸滴定碱时:颜色由红刚好褪色,甲基橙:酸滴定碱时:颜色由黄到橙色,红色退去颜色更明显,所以强酸滴定强碱时,用酚酞指示剂比用甲基橙更易判断滴定终点,故C正确;
D.在从海带提取碘单质的实验中,为了加快碘化物在水中的溶解,使灰烬中的碘离子尽可能多的进入溶液,所以需要将灼烧后的海带灰加水煮沸2-3分钟,故D正确;
故选CD.
点评 本题考查了常见仪器的使用方法、中和滴定中指示剂的选用等知识,题目难度不大,明确常见仪器的构造及化学实验基本操作方法为解答关键,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 新农村建设大量使用秸秆制取沼气,符合低碳理念 | |
| B. | 发霉的大米经过石蜡打磨后可以食用和出售 | |
| C. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全杀灭该病毒,其消毒原理和漂白粉消毒饮用水相同 | |
| D. | 卤水点豆腐、血液透析、静电除尘都是利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(NH3)=0.17mol/(L•min) | D. | v(NH3)=0.01mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1MgCl2溶液中的Mg2+数为nA | |
| B. | 1 mol Na2O2固体中含阴离子总数为2nA | |
| C. | 5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 nA | |
| D. | 100 mL 12mol•L-1 浓盐酸与足量MnO2加热反应,转移电子数为1.2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
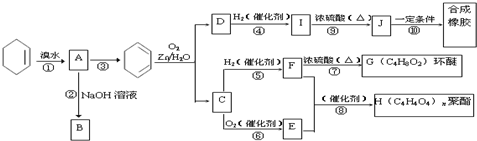
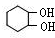 ; COHC-CHO
; COHC-CHO +2nH2O,
+2nH2O,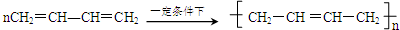
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
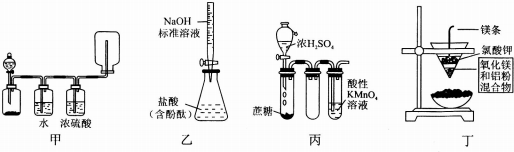
| A. | 甲用于浓盐酸和漂粉精制取并收集干燥的Cl2 | |
| B. | 乙用于测定盐酸的浓度 | |
| C. | 丙用于证明浓硫酸具有脱水性和强氧化性 | |
| D. | 丁用于制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为8NA | |
| C. | 0.44g C3H8中含有的共用电子对总数目为0.08NA | |
| D. | 常温常压下,100 mL 0.5 mol/L 的乙酸溶液中,乙酸的分子数目为0.05NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com