
| A. | $\frac{n(A-N+8)}{A+16}$mol | B. | $\frac{n(A-N+2)}{A}$ mol | C. | $\frac{n(A-N+8)}{A+8}$mol | D. | $\frac{n(A-N-2)}{A}$ mol |
分析 该离子的相对原子质量在数值上等于其质量数,根据n=$\frac{m}{M}$计算ng R2+的物质的量,核内中子数为N的R2+离子,质量数为A,所以质子数为A-N,离子核外电子数为A-N-2,进而计算电子物质的量.
解答 解:核内中子数为N的R2+离子,质量数为A,所以质子数为A-N,离子核外电子数为A-N-2,ng R2+的物质的量为$\frac{ng}{Ag/mol}$=$\frac{n}{A}$mol,含有电子物质的量为$\frac{n}{A}$mol×(A-N-2)=$\frac{n(A-N-2)}{A}$mol,
故选:D.
点评 本题考查物质的量计算以及质子数、中子数、质量数之间的关系,难度不大,有利于基础知识的巩固.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 有MnO2条件下的反应曲线是a曲线 | |
| B. | a曲线变为b曲线,反应所需的活化能降低 | |
| C. | a曲线变为b曲线,平衡时H2O2的转化率增大 | |
| D. | b曲线的热化学方程式为:H2O2(l)=H2O(l)+$\frac{1}{2}$O2(g)△H=-( E1-E2 )kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的焓变是决定反应能否自发进行的唯一因素 | |
| B. | 温度、压强一定时,放热反应能自发进行 | |
| C. | 固体的溶解过程与焓变无关 | |
| D. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .画出G离子的结构示意图
.画出G离子的结构示意图
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
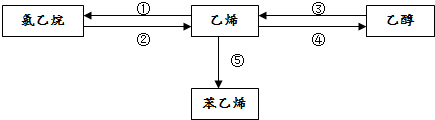
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.72LNO2与水充分反应转移电子数为0.1NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 常温常压下,1mol氦气中含有的核外电子数为2NA | |
| D. | ag某气体含分子数为b,cg该气体在标况下的体积为$\frac{22.4ab}{c{N}_{A}}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将氯化铁固体溶于稀盐酸配制FeCl3溶液 | |
| B. | 称取4.0gNaOH,放入100mL容量瓶中,加水稀释,配制1.0mol•L-1的NaOH溶液 | |
| C. | 利用图1装置定量测定H2O2的分解速率 | |
| D. | 如图2所示,关闭弹簧夹检查装置的气密性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com