
| A. | ②④⑤ | B. | ①③④⑥ | C. | ①②④⑥ | D. | ①②③④⑤ |
分析 化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:A(S)+3B(g)?2C(g)
①C的生成速率与C的分解速率相等,故正逆反应速率相等,故①正确;
②单位时间内a mol A生成是逆反应,同时3a molB是逆反应,未体现正与逆的关系,故②错误;
③密度=$\frac{总质量}{体积}$,气体的总质量会变,体积不变,故气体密度不再变化可作为判断是否达到平衡状态的依据,故③正确;
④反应前后气体的体积不等,故混合气体的总压强不再变化可作为判断是否达到化学平衡状态的依据,故④正确;
⑤平衡时各物质的物质的量之比取决于物质的起始物质的量和转化率,故A、B、C的物质的量比为1:3:2不能作为判断是否达到平衡状态的依据,故⑤错误;
⑥平均相对分子质量=$\frac{总质量}{总物质的量}$,总质量会变,总物质的量也会变,故混合气体的平均相对分子质量不变可作为判断是否达到化学平衡状态的依据,故⑥正确;
说法正确的是①③④⑥,
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中不可能含有共价键 | |
| B. | 晶体中一定存在化学键 | |
| C. | 碱性氧化物一定是金属氧化物 | |
| D. | 直径介于1-10nm之间的微粒称为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂既能加快反应速率又能提高反应物转化率 | |
| B. | 恒温恒容下充入O2,v正、v逆均不变 | |
| C. | 恒温恒容时,混合气体的平均相对分子质量和气体密度保持不变,都能标志反应达到平衡状态 | |
| D. | 当有 2molC≡O 键断裂同时有1molN≡N 键断裂,标志反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人体运动所消耗的能量与化学反应有关 | |
| B. | 煤和石油都属于化石燃料 | |
| C. | 化学反应必然伴随发生能量变化 | |
| D. | 不需要加热就能进行的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 某温度下,在体积一定的密闭容器中适量的NH3气和Cl2气恰好完全反应,产物只有N2气和NH4Cl固体,则反应前后容器中的压强比接近于11:1 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | 向Fe(OH)3胶体中逐滴滴加入过量HI出现先沉淀后溶解现象,最后得到无色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,CO的结构可以表示为
,CO的结构可以表示为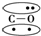 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有叁键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆浆中加入石膏制豆腐 | |
| B. | 晚上,打开手电筒看到一条明亮的光路 | |
| C. | 用“血透”法治疗肾病患者 | |
| D. | 二氧化碳使澄清石灰水变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com