
分析 5min 时达化学平衡,v(N2)=0.08mol/(L•min),可知5min消耗n(N2)=0.08mol/(L•min)×2L×5min=0.8mol,则
N2(g)+3H2(g)?2NH3(g)
起始(mol) 2 3 0
转化(mol)0.8 2.4 1.6
平衡(mol) 1.2 0.6 1.6
以此计算各相关物理量.
解答 解:5min 时达化学平衡,v(N2)=0.08mol/(L•min),可知5min消耗n(N2)=0.08mol/(L•min)×2L×5min=0.8mol,则
N2(g)+3H2(g)?2NH3(g)
起始(mol) 2 3 0
转化(mol)0.8 2.4 1.6
平衡(mol) 1.2 0.6 1.6
(1)达到平衡时,H2的转化率α(H2)=$\frac{2.4}{3}×100%$=80%.
答:达到平衡时,H2的转化率α(H2)为80%;
(2)平衡时NH3的物质的量是1.6mol,NH3的体积分数是$\frac{1.6}{1.2+0.6+1.6}×100%$=47%,
答:平衡时NH3的物质的量是1.6mol;NH3的体积分数是47%;
(3)反应前后的压强比等于物质的量比,即(2+3):(1.2+0.6+1.6)=5:3.4=25:17,
答:反应前后的压强比为25:17.
点评 本题考查了化学平衡的计算,为高频考点,题目难度中等,涉及转化率、体积分数等计算,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡与稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | Al2O3溶于盐酸中:O2-+2H+═H2O | |
| C. | 氯化铝溶液中加入少量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | Cu(OH)2中加入硝酸:Cu(OH)2+2H+═Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 实验现象 | 结论 | |
| A | 将铝片放入盐酸中 | 产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| B | 将形状大小相近的Mg和Al片分别放入相同浓度的盐酸中 | Mg与盐酸反应比Al剧烈 | Mg比Al的金属性强 |
| C | 氢气在氯气中点燃 | 有苍白色火焰,瓶口有白雾 | 该反应为吸热反应 |
| D | 将一小块钠投入冷水中 | 钠熔化成小球 | 反应物的总能量比生成物的总能量低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
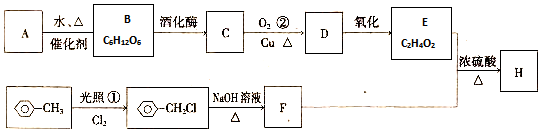
科目:高中化学 来源: 题型:解答题

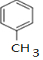 ,D中通过反应②引入的官能团名称为氯原子.
,D中通过反应②引入的官能团名称为氯原子.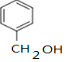 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O. (填结构简式).
(填结构简式).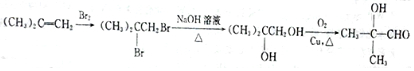 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com