
分析 混合液中c(Ag+)=$\frac{1}{2}$×4×10-3mo1•L-1=2×10-3mo1•L-1,c(CrO42-)=$\frac{1}{2}$×4×10-3mo1•L-1=2×10-3mo1•L-1,
根据离子积与溶度积常数相对大小确定是否产生沉淀,如果离子积大于浓度商,则产生沉淀.
解答 解:混合液中c(Ag+)=$\frac{1}{2}$×4×10-3mo1•L-1=2×10-3mo1•L-1,c(CrO42-)=$\frac{1}{2}$×4×10-3mo1•L-1=2×10-3mo1•L-1,
KSP(Ag2CrO4)=c2(Ag+)•c(CrO42-)=(2×10-3)2×2×10-3=8×10-9>1.12×10-12,所以能够生成铬酸银沉淀,
故答案为:能.
点评 本题考查难溶物的溶解平衡,为高频考点,明确离子积常数与溶度积关系是解本题关键,知道离子积的计算方法,侧重考查学生分析计算能力,注意:二者等体积混合时离子浓度变为原来的一半,为易错点.


科目:高中化学 来源: 题型:选择题
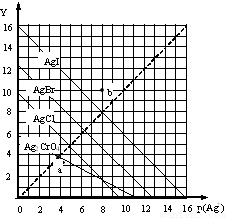 卤化银AgX的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标Y=-lgc(X-).下列说法正确的是( )
卤化银AgX的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标Y=-lgc(X-).下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点时c(Ag+)=c(I-),AgI处于平衡状态 | |
| C. | b点可表示AgBr的不饱和溶液 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙烯(
苯乙烯(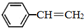 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△=-Q1kJ.mol-1
=CH2(g)+H2(g)△=-Q1kJ.mol-1 .
.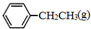 、
、 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用惰性电极电解1L1mol•L-1的CuSO4溶液,当阴极析出3.2g铜时,加入0.05molCu(OH)2固体可将溶液恢复至原浓度 | |
| B. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H>0 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微量元素缺少或者摄入过多,都可能导致患各种代谢疾病 | |
| B. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 | |
| C. | 人体缺钙,可以多喝硬水补钙 | |
| D. | 缺铁性贫血,可通过食用铁强化酱油预防 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com