
【题目】一定条件下,在容积固定的某密闭容器中发生反应N2+3H2![]() 2NH3。在10 s内N2的浓度由5 mol/L降至4 mol/L,下列说法正确的是
2NH3。在10 s内N2的浓度由5 mol/L降至4 mol/L,下列说法正确的是
A.用NH3表示的化学反应速率为0.1 mol/(L·s)
B.使用合适的催化剂,可以加快该反应的速率
C.增加H2的浓度或降低温度都会加快该反应的速率
D.反应足够长时间,N2、H2中至少有一种物质浓度降为零
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】下列选项正确的是( )
A.25℃时,AgBr在0.0lmol/L的MgBr2溶液和NaBr溶液中的溶解度相同
B.53℃时,将0.01mol/L的醋酸溶液加水不断稀释,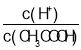 减小
减小
C.Na2CO3、NaHCO3溶液等浓度等体积混合后:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示:
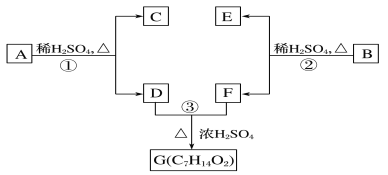
(1) 化合物C的分子式是C7H8O,C是芳香族化合物,遇FeCl3溶液显紫色,C苯环上的一溴代物只有两种,则C的结构简式为______________。
(2) D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D的分子式为_____________,D含有的官能团是__________(填名称)。
(3) 反应①的化学方程式是_____________。
(4) 芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成 E和F,F可能的结构简式是______________。
(5) E可能的结构简式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与100ml稀盐酸反应生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
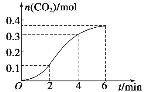
A.反应在2~4min内平均反应速率最大
B.反应在2~4min内用盐酸表示平均反应速率为v(HCl)=0.1mol·L-1·min-1
C.反应开始阶段反应速率逐渐上升是由于温度比浓度对反应速率的影响大
D.4min后,反应速率减小的主要原因是c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用于食品加工和有机合成.以A为原料制备阴离子树脂M和新型聚酯材料N等的合成路线如下:
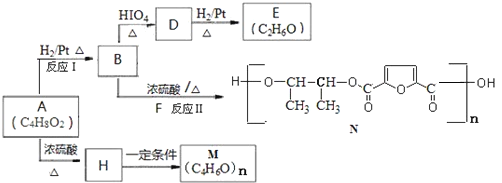
已知:I.![]()
Ⅱ.R-CH═CHOH不稳定,很快转化为R-CH2-CHO
(1)A 中含有的官能团名称为_______________。
(2)反应Ⅱ的反应类型是_________________;并写出反应II的化学方程_____________________________。
(3)反应H→M 的化学方程式是_____________________________________________。
(4)下列关于E的说法正确的是___________________。
a.不溶于水 b.能与H2发生还原反应
c.能被酸性重铬酸钾溶液氧化 d.与NaOH醇溶液共热发生消去反应
(5)A的属于酯类的同分异构体有_______种,其中只含一个甲基的同分异构体的结构简式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室可用如下装置(略去部分夹持仪器)制取SO2并验证其性质。
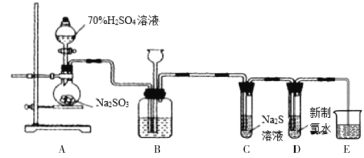
(1)盛装亚硫酸钠的仪器名称为________,若将亚硫酸钠改为铜片,与浓硫酸反应制取SO2,还缺少的仪器有_______,写出用铜片制取SO2的化学方程式_________________________。
(2)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择___________(填代号)。
a.饱和Na2CO3溶液 b.NaOH溶液 c.饱和NaHCO3溶液 d.饱和NaHSO3溶液
(3)验证SO2的还原性。取充分反应后装置D中的溶液,将其分成三份,分别进行如下实验:
方案I:第一份溶液中滴入AgNO3溶液,有白色沉淀生成;
方案II:第二份溶液中滴入品红溶液,红色褪去;
方案III:第三份溶液中滴入BaCl2溶液,产生白色沉淀。
上述方案合理的是___________(填“方案I”、“方案II”或“方案III”);对不合理的方案作出简要评价___________(如果认为都合理,可以不作答)。
II.已知2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,若采用该方案制备Cl2并验证Cl2的性质。B、C、D中的试剂依次为:饱和食盐水、FeCl2溶液、石蕊溶液。
(4)C中反应的离子方程式为:_________________________________。
(5)D中可能观察到的现象为:_________________________________。
(6)装置E中盛放NaOH溶液,其目的是_________________________________,该反应的化学方程式是:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在《科学》(Science)中的一篇论文中,圣安德鲁斯的化学家描绘出了一种使用DMSO(二甲亚砜)作为电解液,并用多孔的黄金作为电极的锂—空气电池的实验模型,这种实验电池在充放电100次以后,其电池容量仍能保持最初的95%。该电池放电时在多孔的黄金上氧分子与锂离子反应,形成过氧化锂,其装置图如图所示。下列有关叙述正确的是

A.多孔的黄金作为正极,负极的电极反应式为Li-e-=Li+
B.DMSO电解液能传递Li+和电子,但不能换成水溶液
C.该电池放电时每消耗2mol空气,转移4mol电子
D.给该锂—空气电池充电时,金属锂接直流电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液 A 逐渐加入固体 B 中,下列叙述中不正确的是( )
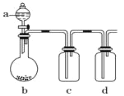
A.若 a 为浓盐酸,b 为 MnO2,c 中盛品红溶液,则 c 中溶液不褪色
B.若 a 为稀硫酸,b 为 FeS,c 中盛硫酸铜溶液,则 c 中产生淡黄色沉淀
C.若 a 为醋酸溶液,b 为贝壳,c 中盛过量澄清石灰水,则 c 中溶液变浑浊
D.若 a 为浓氨水,b 为生石灰,c 中盛 AlCl3 溶液,则 c 中产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产中都有重要应用。
(1)氮和肼(N2H4)是两种最常见的氮氢化物。
已知:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是______(填字母代号)。
A.c(CO)=c(CO2)
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
②图1为容器内的压强(p)与起始压强(p0)的比值![]() 随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。
随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。

(3)使用间接电化学法可处理燃烧烟气中的NO,装置如图所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:____________________。用离子方程式表示吸收池中除去NO的原理____________________________________________。

【答案】 4NH3(g)+O2(g)2N2H4(g)+2H2O(g)ΔH=+526.2 kJ·mol-1 K1/K22 D 0.006 mol·L-1·min-1 80% 2HSO3-+2e-+2H+===S2O42-+2H2O 2NO+2S2O42-+2H2O===N2+4HSO3-
【解析】(1)①4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=
N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=![]() ,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol;
,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol; ![]() ;
;
(2)对于2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①A.c(CO)=c(CO2),不表示浓度变化,不能判断是否为平衡状态,故A错误;B.反应中气体的质量不变,体积不变,容器中混合气体的密度始终不变,不能判断是否为平衡状态,故B错误;C.v(N2)正=2v(NO)逆表示,应该是2v(N2)正=v(NO)逆,才表示正逆反应速率相等,故C错误;D.该反应属于气体的物质的量发生变化的反应,容器中混合气体的平均摩尔质量不变时表示气体的物质的量不变, 说明是平衡状态,故D正确;故选D;
②根据容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线,0~5min内,![]() =0.925,根据阿伏伽德罗定律及其推论,
=0.925,根据阿伏伽德罗定律及其推论,![]() =0.925,平衡时
=0.925,平衡时![]() =0.90,
=0.90,
2NO(g)+ 2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol) 0.1 0.3 0 0
反应 2x 2x x 2x
5min及平衡 0.1-2x 0.3-2x x 2x
5min时,![]() =0.925,解得x=0.03mol,v(N2)=
=0.925,解得x=0.03mol,v(N2)=![]() = 0.006mol·L-1·min-1;平衡时,
= 0.006mol·L-1·min-1;平衡时,![]() =0.90,解得x=0.04mol,NO的转化率=
=0.90,解得x=0.04mol,NO的转化率=![]() ×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
(3)阴极发生还原反应,是亚硫酸氢根离子,得电子,生成硫代硫酸根离子,电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O;硫代硫酸根离子与一氧化氮发生氧化还原反应,生成氮气,离子反应方程式为:2NO+2S2O42-+2H2O═N2+4HSO3-;故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-。
【题型】填空题
【结束】
10
【题目】锂离子电池是目前具有最高比能量的二次电池。LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择。生产LiFePO4的一种工艺流程如图:

已知:Ksp(FePO4·xH2O)=1.0×10-15,Ksp[Fe(OH)3]=4.0×10-38。
(1)在合成磷酸铁时,步骤Ⅰ中pH的控制是关键。如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是________________。
(2)步骤Ⅱ中,洗涤是为了除去FePO4·xH2O表面附着的________等离子。
(3)取3组FePO4·xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如下表:
实验序号 | 1 | 2 | 3 |
固体失重质量分数 | 19.9% | 20.1% | 20.0% |
固体失重质量分数= ×100%,则x=_______(精确至0.1)。
×100%,则x=_______(精确至0.1)。
(4)步骤Ⅲ中研磨的作用是__________________________________。
(5)在步骤Ⅳ中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为________。
(6)H3PO4是三元酸,如图是常温下溶液中含磷微粒的物质的量分数(δ)随pH变化示意图。则PO![]() 第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com