
【题目】X、Y、Z、Q、R为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图所示。R原子最外层电子数Q原子最外层电子数的4倍,Q的简单离子核外电子排布与Z2-相同。下列相关叙述不正确的是

A. 化合物![]() 中含有离子键
中含有离子键
B. 五种元素中Q的金属性最强
C. 气态氢化物的稳定性:![]()
D. 最高价氧化物对应的水化物酸性:![]()
【答案】A
【解析】
X、Y、Z、Q、R为原子序数依次增大的短周期主族元素,R原子最外层上的电子数是Q原子最外层电子数的4倍,则Q只能处于IA族,R处于ⅣA族,R与X最外层电子数相同,二者同主族,且R的原子半径较大,故X为C元素、R为Si元素;最外层电子数Z>Y>4,且二者原子半径小于碳原子,故Y、Z处于第二周期,Z能够形成离子Z2-,故Z为O元素,则Y为N元素;Q离子核外电子排布与O2-相同,且Q处于IA族,故D为Na,据此进行解答。
根据上述分析可知X是C元素,Y是N元素,Z是O元素,R是Si元素,Q是Na元素。
A.化合物XZ2是CO2,该物质是共价化合物,由分子构成,分子中含有共价键,A错误;
B.在上述五种元素中只有Q表示的Na元素是金属元素,因此五种元素中Q的金属性最强,B正确;
C.元素的非金属性越强,其简单氢化物的稳定性就越强。由于元素的非金属性N>C,所以氢化物的稳定性NH3>CH4,C正确;
D.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。由于元素的非金属性N>Si,所以酸性:HNO3>H2SiO3,D正确;
故合理选项是A。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)鉴别KCl溶液和K2CO3的试剂名称是_______,离子方程式为_____________。
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂名称是_______________,离子方程式为_____________________________。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用___________方法,化学方程式为______________________________________________。
(4)除去铁粉中混有铝粉的试剂名称是_______,化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志。根据下面转化关系回答问题。

(1)分别写出A和E中官能团的名称:A中_________;E中_________;
(2)操作⑥的名称为________________。
(3)写出反应类型:④_________;
(4)请写出下列反应的化学方程式:
①写出A和B在浓硫酸中加热反应的方程式_________________;
②B在金属铜存在下在空气中加热反应________________;
(5)F是一种常见的高分子材料,它给我们带来了巨大的方便。然而,这种材料造成的当今的某一环境问题是__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电子式的表述正确的是( )
A.HClO的电子式为
B.SCl2的电子式为
C.用电子式表示HCl的形成过程为
![]()
D.已知SCN-每个原子都达到8电子结构,则其电子式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL ![]() 溶液中滴加
溶液中滴加![]() 的
的![]() 溶液,滴加过程中,溶液中
溶液,滴加过程中,溶液中![]() 与
与![]() 溶液体积(V)的关系如图所示,下列说法正确的是( )已知:
溶液体积(V)的关系如图所示,下列说法正确的是( )已知: ![]() 。
。
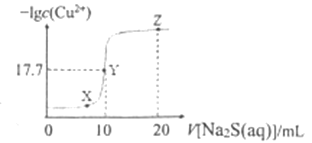
A. 该温度下 ![]()
B. X、Y、Z三点中,Y点水的电离程度最小
C. ![]() 溶液中:
溶液中:![]()
D. 向100 mL ![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是应用广泛的化工原料和前景乐观的无色液体燃料。请按要求回答下列问题。
(1)已知25℃、101 kpa时一些物质的燃烧热如下表:
物质 | CH3OH(l) | CO(g) | H2(g) |
燃烧热/(kJ/mol) | 726.8 | 283.0 | 285.8 |
写出由CO和H2反应生成CH3OH(l)的热化学方程式: _________________________。
(2)一定温度下,在容积为2L的恒容密闭容器中进行反应:CO(g)+2H2(g)=CH3OH(g),其相关数据如图所示。

①从反应开始至5min时,用CH3OH表示的反应平均速度为____________。
②图中反应达平衡时,K=_______(mol/L)-2;CO的平衡转化率为________________。
(3)人们利用甲醇制得能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,该装置工作时,a极反应式为____________________。

若用该电池及惰性电极电解2L饱和和食盐水产生224mL(标准误差2)Cl2时(假设全部句逸出并收集,忽略溶液体积的变化),常温下所得溶液的pH为________。
(4)甲醇在一定条件下可转化为甲酸。常温下,向0.1mol/L HCOOH溶液中滴加0.1mol/LNaOH溶液至pH=7[已知,K(HCOOH)=1.8×10-4]。此时混合游学中两溶质的物质的量之比n(HCOOH):n(HCOONa)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题。
(1)配制100mL 2mol/L的NH4Cl溶液。该同学应用天平称量NH4Cl固体的质量为______g。
(2)有以下仪器:烧杯、胶头滴管、玻璃棒、量筒等玻璃仪器。
①还缺少的玻璃仪器有__________;
②使用此仪器前必须进行的一步操作是_______;
(3)该同学又用如图所示的装置收集干燥纯净的氨气并做性质实验:

①写出A处氯化铵与熟石灰反应的化学方程式:______________
②B中盛放的是__________其作用是__________
③氨水中滴加酚酞溶液变为________色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)=4C(g)+6D(g),在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.30mol。下列叙述正确的是( )
A.容器中含D物质的量至少为0.45mol
B.A的平均反应速率是![]()
C.容器中A、B、C、D的物质的量之比一定是4:5:4:6
D.容器中A的物质的量一定增加了0.30mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com