
| A. | 延展性 | B. | 导电性 | C. | 弹性 | D. | 导热性 |
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 46gC2H6O中含有的C-H键数一定为5NA | |
| B. | 常温常压下,46g由NO2和N2O4组成的混合气体中含有原子的总数为3NA | |
| C. | 将15.6gNa2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA | |
| D. | 2molSO2和1molO2混合,所得气体的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数 | B. | 相对分子质量 | C. | 质量 | D. | 密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C在O2充足时,发生的反应主要是放热反应 | |
| B. | 煤燃烧时吹入的氧气越多越好 | |
| C. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO这一反应属于吸热反应 | |
| D. | 煤燃烧时,反应物自身总能量高于生成物总能量,所以放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
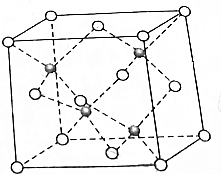 Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag•cm-3,则Cu与F最近距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×83}{{aN}_{A}}}$×1010 pm.(阿伏加德罗常数用NA表示,列出计算表达式,不用化简:图中○为Cu,
Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag•cm-3,则Cu与F最近距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×83}{{aN}_{A}}}$×1010 pm.(阿伏加德罗常数用NA表示,列出计算表达式,不用化简:图中○为Cu, 为F)
为F)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
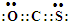 .
.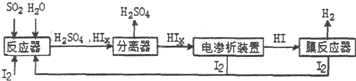
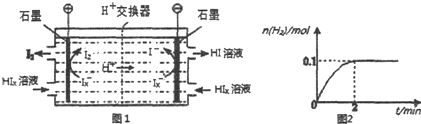
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 条件 | 离子组 | 共存所发生的离子反应方程式 |
| A | pH=1的溶液 | Fe2+、Al3+、Cl-、MnO4- | 10Cl-+2MnO4-+16H+═2Mn2++5Cl2↑+8H2O |
| B | 能与铝反应生成氢气的溶液 | K+、NO3-、Cl-、NH4+ | NH4++OH-═NH3•H2O |
| C | 常温下c(H+)/c(OH)-=10-10的溶液 | Na+、Cl-、S2-、SO32- | SO32-+2S2-+6H+═3S↓+3H2O |
| D | 含有大量H+的透明溶液 | Na+、Cu2+、AlO2-、SiO32- | 2H++SiO32-═H2SiO3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com