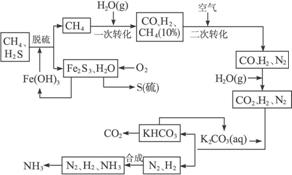
完成下列填空
(1)下列物质能导电的是______,属于强电解质的是______,属于弱电解质的是______,属于非电解质的是______.
a.铜丝 b.金刚石 c.石墨 d.NaCl e.盐酸 f.蔗糖 g.CO2 h.Na2O i.硬脂酸 j.醋酸k.碳酸 l.碳酸氢铵 m.氢氧化铝 n.氯气 P BaSO4
(2)有氢离子浓度相同、体积相等的三种酸:a、盐酸 b、硫酸 c、醋酸,p同时加入足量的锌,则开始反应时速率______,反应完全后生成H2的质量______.(用<、=、>表示)
(3)物质的量浓度相同的盐酸、硫酸和醋酸溶液,pH最小的是______,pH最大的是______;体积相同时分别与同种NaOH溶液反应,消耗NaOH溶液的体积大小关系为______.
(4)已知1mol N2与适量 H2反应生成NH3放出92.2KJ热量.写出表示该反应的热化学方程式______
(5)4.0g硫在氧气中完全燃烧放出37kJ热量,则硫的燃烧热为______
(6)BaSO4(溶解平衡表达式)______
(7)H2CO3(电离方程式)______
(8)NH4Cl(水解离子方程式)______
(9)NaHCO3溶液中存在那些微粒?______.
【答案】
分析:(1)水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物不管在水溶液中或熔融状态下能够导电与否,都不是电解质或非电解质.能导电的物质--必须具有能自由移动的带电的微粒,金属能导电--是由于金属中存在能自由移动的带负电的电子,强电解质是在水溶液中能完全电离的电解质,弱电解质是在水溶液里部分电离的电解质;
(2)化学反应速率与浓度成正比,考虑弱酸的部分电离;
(3)一分子硫酸能产生2个H
+,盐酸只能产生一个H
+;物质的量浓度相同,n(H
+)硫酸是盐酸的两倍.
醋酸也能产生一个H
+,但醋酸是弱酸,不能完全解离;
(4)根据热化学方程式的书写要求;
(5)根据热化学方程式的书写方法,注意燃烧热可燃物为1mol;
(6)根据溶解平衡方程式的书写方法;
(7)多元弱酸的电离以第一步为主;
(8)根据水解方程式的书写方法;
(9)在NaHCO
3溶液中,NaHCO
3完全电离出Na
+和HCO
3-,而HCO
3-又能水解产生H
2CO
3和OH
-,同时又能电离出H
+和CO
32-,再加上水电离出的H
+和OH
-.
解答:解:(1)能导电的物质--必须具有能自由移动的带电的微粒,金属铜和石墨中存在能自由移动的带负电的电子能导电,盐酸醋酸碳酸中都有能自由移动的正负离子,也能导电;强电解质是在水溶液中能完全电离的电解质,NaCl、BaSO
4在水溶液里完全电离,Na
2O在熔融状态下完全电离;弱电解质是在水溶液里部分电离的电解质,硬脂酸、醋酸、碳酸、氢氧化铝在水溶液里部分电离;蔗糖在水溶液中或熔融状态下均不导电,二氧化碳的水溶液能导电,但不是它本身导电,属于非电解质,故答案为:acejk;dhp;ijkm;fg;
(2)化学反应速率与浓度成正比,开始时氢离子浓度相同,化学反应速率相同,盐酸和硫酸中氢离子的物质的量相等,生成的氢气相等,考虑弱酸的部分电离,醋酸的浓度比盐酸和硫酸的大,生成的氢气多,故答案为:相同;a=b<c;
(3)一分子硫酸能产生2个H
+,盐酸只能产生一个H
+;物质的量浓度相同,n(H
+)硫酸是盐酸的两倍.
醋酸也能产生一个H
+,但醋酸是弱酸,不能完全解离,也就是说醋酸的物质量要比盐酸的小,所以pH最小的是硫酸,pH最大的是醋酸,体积相同时分别与同种NaOH溶液反应,消耗NaOH溶液的体积大小关系为:v硫酸=2v盐酸>2v醋酸,
故答案为:硫酸;醋酸;v硫酸=2v盐酸>2v醋酸;
(4)热化学方程式为:N
2(g)+3H
2(g)
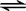
2NH
3(g)△H=-92kJ?mol
-1,
故答案为:N
2(g)+3H
2(g)
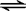
2NH
3(g)△H=-92kJ?mol
-1;
(5)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ的热量,所以32g硫粉完全燃烧生成二氧化硫气体,放出296kJ的热量,则热化学方程式为:S
(s)+O
2(g) ═SO
2(g) △H=-296KJ/mol,
故答案为:S
(s)+O
2(g)═SO
2(g)△H=-296KJ/mol;
(6)硫酸钡溶解平衡方程式:BaSO
4(s)
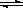
Ba
2+(aq)+SO
42-(aq),
故答案为:BaSO
4(s)
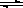
Ba
2+(aq)+SO
42-(aq);
(7)H
2CO
3电离方程式:H
2CO
3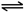
H
++HCO
3-,故答案为:H
2CO
3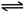
H
++HCO
3-;
(8)NH
4Cl水解方程式:NH
4++H
2O
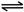
H
++NH
3?H
2O,故答案为:NH
4++H
2O
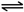
H
++NH
3?H
2O;
(9)在NaHCO
3溶液中,NaHCO
3完全电离出Na
+和HCO
3-,而HCO
3-又能水解产生H
2CO
3和OH
-,同时又能电离出H
+和CO
32-,再加上水电离出的H
+和OH
-.因此溶液中共有两种分子(H
2O、H
2CO
3)和五种离子(H
+、Na
+、OH
-、CO
32-、HCO
3-),
故答案为:两种分子(H
2O、H
2CO
3)和五种离子(H
+、Na
+、OH
-、CO
32-、HCO
3-).
点评:本题是一道综合题,难度适中,注意元素化合物知识的积累,(3)为学生解答中的易错点.

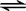 2NH3(g)△H=-92kJ?mol-1,
2NH3(g)△H=-92kJ?mol-1,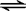 2NH3(g)△H=-92kJ?mol-1;
2NH3(g)△H=-92kJ?mol-1;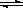 Ba2+(aq)+SO42-(aq),
Ba2+(aq)+SO42-(aq),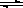 Ba2+(aq)+SO42-(aq);
Ba2+(aq)+SO42-(aq);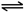 H++HCO3-,故答案为:H2CO3
H++HCO3-,故答案为:H2CO3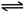 H++HCO3-;
H++HCO3-;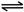 H++NH3?H2O,故答案为:NH4++H2O
H++NH3?H2O,故答案为:NH4++H2O 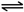 H++NH3?H2O;
H++NH3?H2O;



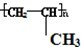
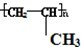


 ;若
;若 在上述类似条件下发生反应,请模仿上例写出该反应的方程式:
在上述类似条件下发生反应,请模仿上例写出该反应的方程式:




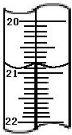 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为: d.CH2=CHCH3.
d.CH2=CHCH3.