
【题目】给出下列氧化还原反应,试回答下列问题。
(1)KMnO4+ KI+ H2SO4 K2SO4+ MnSO4 + I2十 H2O
配平化学反应方程式 被还原的元素 ,发生氧化反应的物质 。
(2)3Cl2 + 6NaOH![]() 5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
用双线桥标出电子转移的方向和数目 氧化剂与还原剂的物质的量之比为 ,氧化产物是 。
(3)11P+15CuSO4+24H2O=6H3PO4+15H2SO4+5Cu3P(反应中Cu3P中的P为负三价)。
该反应中Cu2+表现 性(填氧化或还原);11molP中被P氧化的P是 mol
【答案】(1)2KMnO4+10KI+8H2SO4 ![]() 6K2SO4+ 2MnSO4 +5I2十8H2O Mn,KI 得5e-
6K2SO4+ 2MnSO4 +5I2十8H2O Mn,KI 得5e-
(2)3Cl2 + 6NaOH ![]() 5NaCl + NaClO3 + 3H2O 5:1 , NaClO3; 失5e-
5NaCl + NaClO3 + 3H2O 5:1 , NaClO3; 失5e-
(3)氧化性 6
【解析】
试题分析:(1)利用化合价升降法配平,该反应的化学方程式为2KMnO4+10KI+8H2SO4 ![]() 6K2SO4+ 2MnSO4 +5I2十8H2O ,锰元素的化合价由+7价降为+2价,故被还原的元素为Mn,碘元素的化合价由-1价升高为0价,故发生氧化反应的物质KI。
6K2SO4+ 2MnSO4 +5I2十8H2O ,锰元素的化合价由+7价降为+2价,故被还原的元素为Mn,碘元素的化合价由-1价升高为0价,故发生氧化反应的物质KI。
(2)反应:3Cl2 + 6NaOH![]() 5NaCl + NaClO3 + 3H2O中,有2.5molCl2中氯元素的化合价由反应前的0价变为反应后的-1价,有0.5molCl2中氯元素的化合价由反应前的0价变为反应后的+5价,氧化剂与还原剂的物质的量之比为5:1,氧化产物是NaClO3。
5NaCl + NaClO3 + 3H2O中,有2.5molCl2中氯元素的化合价由反应前的0价变为反应后的-1价,有0.5molCl2中氯元素的化合价由反应前的0价变为反应后的+5价,氧化剂与还原剂的物质的量之比为5:1,氧化产物是NaClO3。
(3)反应:11P+15CuSO4+24H2O=6H3PO4+15H2SO4+5Cu3P(反应中Cu3P中的P为负三价),铜元素的化合价由+2价降为+1价,故该反应中Cu2+表现氧化性;11molP中有6mol由0价升高为+5价,被氧化。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CaS用于制备除虫剂、发光材料等。某课题组拟用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物。
(1)甲同学设计如图实验装置检验气体产物:
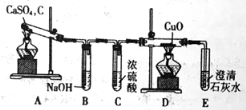
①B装置作用是 ;
②D和E装置能检验装置A的反应产物是 ;
③E装置中可能出现的现象是 。
(2)乙同学提出,根据氧化还原反应,A中的气体产物可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计方案(同一种仪器可重复使用)。
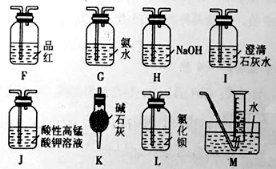
①气流从左至右,仪器连接顺序为A、F 。
②能证明有SO2的现象是 ;能证明有CO2的现象是 。
③除去SO2的离子方程式为 。
(3)经试验检验气体产物有SO2、CO、CO2且气体体积之比为1:1:2,写出A中反应的化学方程式 。
(4)利用重量法测定固体产物的质量之比,即将样品溶于足量的饱和碳酸钠溶液,过滤洗涤、干燥等。需要测定的物理量有 。(已知CaS与H2O反应生成Ca(OH)2和H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.化学电池的反应基础是氧化还原反应
B.铅蓄电池是二次电池
C.燃料电池是一种高效,但是污染环境的发电装置
D.锌锰干电池是一次性电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下:
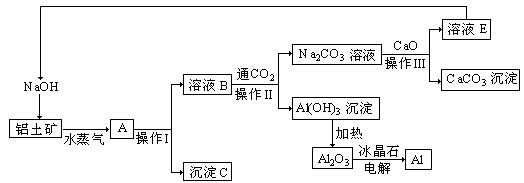
请回答下列问题:(1)水蒸气的作用 ;
(2)沉淀C的化学式为________,该物质除了用于金属冶炼以外,还可用作________;
(3)操作I、操作II、操作III都用到的玻璃仪器是有________________;
(4)写出制备过程中由溶液B生成Al(OH)3的离子方程式 ;
(5)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
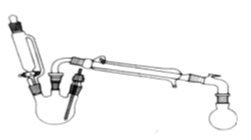
【题目】某研究性小组探究乙酸乙酯的反应机理,实验如下:
CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)
已知:相关物理性质(常温常压)
密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
乙醇 | 0.79 | -114 | 78 | 溶 |
乙酸 | 1.049 | 16.2 | 117 | 溶 |
乙酸乙酯 | 0.902 | 84 | 76.5 | 不溶 |
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪
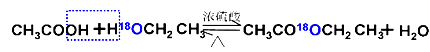
用醋酸羟基氧示踪

含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理 。
2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K= 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合? 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质? 。饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净? 。用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类是工业上重要的有机原料,具有广泛用途。
乙酸苯甲酯(![]() )对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
)对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
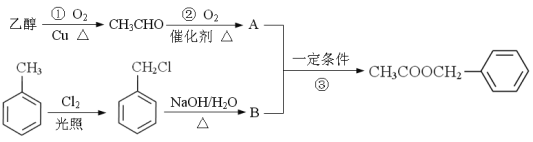
已知:R-Cl![]() R-OH , R- 为烃基)
R-OH , R- 为烃基)
(1)A的结构简式为 ,B所含官能团的名称是 ;
反应③的类型是 。
(2)下列物质中能与A的水溶液反应的是 。(填序号)
A.CaCO3 B.NaOH C.CuSO4 D.NaCl E.Zn
任写一个以上能与A的水溶液反应的化学方程式 。
![]() (3)下列转化中 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
(3)下列转化中 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
A.乙醇制取乙醛
B.由![]() 制备
制备
C.2CH3CHO + O2![]() 2A
2A
(4)写出反应①的化学反应方程式 。
反应①的反应类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,CuSO4在水中溶解度为25g,将32gCuSO4白色粉末加入到mg水中,形成饱和CuSO4溶液,并有CuSO4·5H2O晶体析出,则m的取值范围是
A. 18g≤m≤128g B. 36g<m<180g
C. 18g<m<128g D. 36g<m≤180g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异噁草酮是一种色素抑制类除草剂,它的工业合成路线如下:
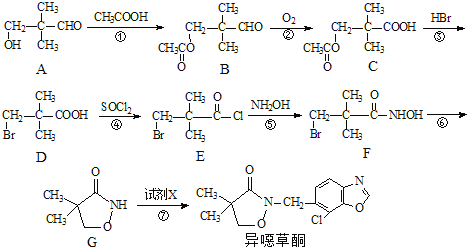
(1)从 A→D 过程中,反应①的目的是____________________。
(2)写出满足下列条件的A的一种同分异构体的结构简式____________________。
①与 A 具有相同的官能团;
②分子中具有两个手性碳原子(连有四个不同基团的碳原子称为手性碳原子)。
(3)物质 D与 NaOH 溶液反应的化学方程式为____________________。
(4)由 G 制备异噁草酮的反应中要加入试剂 X(C8H5NOCl2),X 的结构简式为_______________。
(5)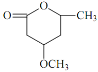 是B的一种重要的同分异构体。请设计合理方案,完成从
是B的一种重要的同分异构体。请设计合理方案,完成从![]() 到
到 的合成路线(用合成路线流程图表示,并注明反应条件)。
的合成路线(用合成路线流程图表示,并注明反应条件)。
![]()
![]() ……
……
提示:① ![]() ;②合成过程中无机试剂任选;③合成路线流程图示例如下:
;②合成过程中无机试剂任选;③合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A. 原子半径大小:Ca>S
B. 金属性强弱:Na<Mg
C. 酸性强弱:HBrO4>HClO4
D. 碱性强弱:NaOH> KOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com