
| A. | CO2 | B. | NO2 | C. | N2 | D. | H2 |
科目:高中化学 来源: 题型:实验题

| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 | |
| B. | 用排水集气法便可以收集到氯气 | |
| C. | 氯气有漂白性 | |
| D. | 自来水常用氯气来杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol/(L•s) | B. | 0.5 mol/(L•s) | C. | 0.1 mol/(L•s) | D. | 0.2 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 增大密闭容器的容积 | ||
| C. | 使用催化剂 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率减小,逆反应速率增大 | |
| B. | 降低温度,正反应速率增大,逆反应速率减小 | |
| C. | 增大压强,正、逆反应速率都增大 | |
| D. | 减小压强,正、逆反应速率都不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
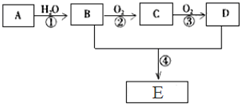 已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.
已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com