
分析 (1)①配制480ml0.2mol•L-1的FeSO4溶液,需用500ml容量瓶,则配制出的FeSO4溶液为500ml0.2mol•L-1,根据n=c•V计算出需要硫酸亚铁的物质的量,再根据m=n•M计算出需要绿矾的质量;③定容基本操作为:向容量瓶中加水至液面接近刻度线 1-2cm处,改用胶头滴管加水,使溶液凹液面与刻度线相切;
(2)根据配制一定物质的量浓度的溶液的配制步骤进行排序;
(3)容量瓶在使用前需要进行的操作是检查是否漏水;
(4)根据实验操作的规范性分析误差,若没有进行⑤操作,烧杯和玻璃棒洗涤液中溶质会损失,根据cB=n/V可得定容时,配制的溶液的浓度偏低;称量时,所用的砝码已经生锈,导致溶质的物质的量偏大,所配得溶液的浓度偏高;定容时眼睛仰视刻度线,则容量瓶中溶液的体积增多,配制的溶液的浓度偏低;
(5)向容量瓶移液时,不慎有液体溅出,移入容量瓶中氢氧化钠的物质的量偏小,应倒掉溶液,洗净容量瓶后重新配制.
解答 解:(1)①配制480ml0.2mol•L-1的FeSO4溶液,需用500ml容量瓶,则配制出的FeSO4溶液为500ml0.2mol•L-1,而配制500ml0.2mol•L-1的FeSO4溶液中含有硫酸亚铁的物质的量为:0.2mol•L-1×0.5L=0.1mol,需要FeSO4•7H2O的质量为:278g/mol×0.1mol=27.8g,
故答案为:①27.8g ③1-2cm,胶头滴管;
(2)配制一定物质的量浓度溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以操作步骤和正确顺序为:④①②⑤③⑥,
故答案为:④①②⑤③⑥;
(3)容量瓶在使用前需要进行的操作是检查是否漏水,
故答案为:检查是否漏水;
(4)若没有进行⑤操作,烧杯和玻璃棒洗涤液中溶质会损失,根据cB=n/V可得定容时,配制的溶液的浓度偏低;称量时,所用的砝码已经生锈,导致溶质的物质的量偏大,所配得溶液的浓度偏高;定容时眼睛仰视刻度线,则容量瓶中溶液的体积增多,配制的溶液的浓度偏低,
故答案为:偏低 偏高 偏低;
(5)向容量瓶移液时,不慎有液体溅出,移入容量瓶中氢氧化钠的物质的量偏小,应倒掉溶液,洗净容量瓶后重新配制,
故答案为:重做实验.
点评 本题考查了一定物质的量浓度溶液的计算和仪器的选择以及误差的分析,熟练实验过程和操作是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
在实验室从自来水制取蒸馏水的实验中,下列说法错误的是
A.烧瓶中要放入碎瓷片防止暴沸 
B.温度计的水银球放在支管口附近位置,不能插入液面下
C.冷凝水应该是下进上出,与蒸气的流向相反
D.开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的pH变大 | |
| B. | 盐酸和醋酸都可用相应的钠盐与浓度硫酸反应制取 | |
| C. | 相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大 | |
| D. | 相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO32-+Cl2=2HCO3-+Cl-+ClO- | |
| C. | 向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5 | |
| D. | 向浓度均为1×10-3mol/L的KCl和K2CrO4混合液中滴加1×10-3mol/L的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ•mo-l,逆反应的活化能为Eb kJ•mol-l,则△H=-( Ea-Eb)kJ.mol-l | |
| B. | 某温度下,氯化钠在水中的溶解度是20 g,则该温度下的饱和氯化钠溶液溶质的质量分数为20% | |
| C. | 将0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
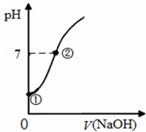 常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在次氯酸的电离平衡 | |
| B. | ②点所示溶液中:c(Na+)═c(Cl-)+c(ClO-) | |
| C. | I-能在②所示溶液中存在 | |
| D. | ①到②水的电离程度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
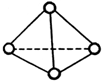 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )| A. | 1molN4气体转化为N2时要吸收206kJ能量 | |
| B. | N4是一种新型化合物 | |
| C. | 1molN4气体转化为N2时要放出740kJ能量 | |
| D. | N4是N2的同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com