
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 绿色化学的核心是利用化学原理治理环境污染 | |
| C. | 将煤气化或液化,获得清洁燃料 | |
| D. | 向高空排放金属冶炼产生的粉尘 |
分析 A.Si为半导体材料,计算机芯片的材料是Si;
B.绿色化学的核心是从源头上减少对环境的污染;
C.将煤气化生成CO和氢气,液化生成甲醇;
D.高空排放金属冶炼产生的粉尘,污染大气环境.
解答 解:A.Si为半导体材料,计算机芯片的材料是Si,而二氧化硅为光纤的材料,故A错误;
B.绿色化学的核心是从源头上减少对环境的污染,而不能污染后再治理,故B错误;
C.将煤气化生成CO和氢气,液化生成甲醇,均可获得清洁燃料,故C正确;
D.高空排放金属冶炼产生的粉尘,污染大气环境,形成雾霾等,不能排放在高空中,故D错误;
故选C.
点评 本题考查物质的性质及用途,为高频考点,把握物质的性质、性质与用途为解答的关键,侧重分析与应用能力的考查,注意化学与生活、环境的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 食品袋中常放有硅胶和铁粉,都能起到干燥的作用 | |
| B. | 大力实施矿物燃料脱硫脱硝技术,能减少硫、氮氧化物的排放 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 洗涤脱排油烟机表面的油脂污物时,热的纯碱溶液比冷的去污效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O | |
| B. | FeBr2溶液中通入等物质的量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 酸性KMnO4溶液中加H2O2,紫色褪去:2MnO4-+H2O2+6H+=2Mn2++3O2↑+4H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H++OH-、HCO3-+H2O
H++OH-、HCO3-+H2O +H2CO3+OH-、HCO3-+H2O
+H2CO3+OH-、HCO3-+H2O H3O++CO32-
H3O++CO32- 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸甲酯 | B. | 甲酸乙酯 | C. | 乙酸乙酯 | D. | 乙酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可作漂白剂和供氧剂,碳酸钠可用于治疗胃酸过多 | |
| B. | 工业上用次氯酸制漂白粉,保存漂白粉的塑料袋要密封 | |
| C. | 氯气用于自来水消毒,是因为生成的次氯酸有杀菌、消毒的作用 | |
| D. | 溴化银用于人工降雨,单质碘加入食盐中用于制加碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
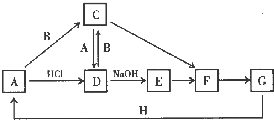 A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素.
A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素.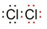 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅②③④⑤⑥⑧ | B. | 仅③⑤⑥⑧ | C. | 仅①②④⑦ | D. | 除①外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

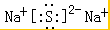 ,A的晶体类型离子晶体.
,A的晶体类型离子晶体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com