
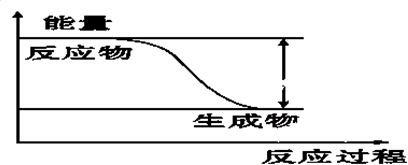


科目:高中化学 来源: 题型:
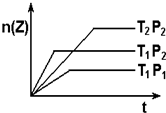 反应2X(g)+Y(g)?2Z△H<0 在不同温度和压强下,产物Z的物质的量与反应时间的关系如图所示.则下列叙述正确的是( )
反应2X(g)+Y(g)?2Z△H<0 在不同温度和压强下,产物Z的物质的量与反应时间的关系如图所示.则下列叙述正确的是( )| A、T1>T2,P1<P2 |
| B、T1>T2,P1>P2 |
| C、T1<T2,P1>P2 |
| D、T1<T2,P1<P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
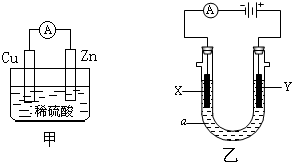 某化学兴趣小组的同学用如图装置研究电化学的问题.
某化学兴趣小组的同学用如图装置研究电化学的问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
283 116 |
| A、这种元素一定是金属元素 |
| B、它位于元素周期表中的第六周期 |
| C、这种原子的核外电子数为167 |
| D、这种元素的原子易与氢化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、产生的CO2的量相同 |
| B、产生的H2O的量相同 |
| C、消耗的O2的量相同 |
| D、产物的总物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com