
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 一定条件下,1 mol N2与足量H2反应生成NH3,转移电子6NA | |
| C. | pH=13的氢氧化钠溶液中所含Na+为0.1NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
分析 A.H218O与D2O的摩尔质量均为20g/mol,且H218O与D2O中均含10个中子;
B.氮气与氢气反应为可逆反应,不能进行到底;
C.溶液体积未知;
D.二氧化锰只能与浓盐酸反应,稀盐酸和二氧化锰不反应.
解答 解:A.H218O与D2O的摩尔质量均为20g/mol,故2.0g混合物的物质的量为0.1mol,而且H218O与D2O中均含10个中子,故0.1mol混合物中含1mol中子即NA个,故A正确;
B.氮气与氢气反应为可逆反应,一定条件下,1 mol N2与足量H2反应生成NH3的物质的量小于2mol,转移电子小于6NA,故B错误;
C.溶液体积未知,无法计算钠离子个数,故C错误;
D.二氧化锰只能与浓盐酸反应,一旦浓盐酸变稀,反应即停止,4molHCl反应时转移2mol电子,而50mL12mol/L盐酸的物质的量n=CV=12mol/L×0.05L=0.6mol,这0.6mol盐酸不能完全反应,则转移的电子的物质的量小于0.3mol电子,即小于0.3NA个,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用是解题关键,注意可逆反应不能进行到底的特点、二氧化锰与稀盐酸不反应的特点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 材料是为人类社会所需要并能用于制造有用器物的物质 | |
| B. | 人类使用和制造材料有悠久的历史,制造出的第一种材料是陶 | |
| C. | 体型结构的酚醛树脂制成的塑料,加工成型后,受热熔化后还可以制成其它形状的器物 | |
| D. | 高分子分离膜是具有传统高分子材料的机械性能,又具有特殊分离功能的功能高分子材料制成的薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电解法精炼铜时粗铜作阴极 | |
| B. | 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 | |
| C. | 化学平衡常数K只与温度有关,与反应物浓度、体系的压强无关 | |
| D. | 需要加热的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
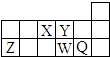
| A. | 离子半径的大小顺序为W>Q>Y>Z | |
| B. | X、Y、W三种元素的非金属性大小顺序为X>Y>W | |
| C. | X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应 | |
| D. | 元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| D. | FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa参加氧化还原反应时转移电子数为NA | |
| B. | 3.2gSO2与2.3gNO2所含有的氧原子数相等 | |
| C. | 1molNa2O2与足量水反应后转移的电子数为2NA | |
| D. | 1L0.1mol/LMgCl2溶液中Cl-离子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com