
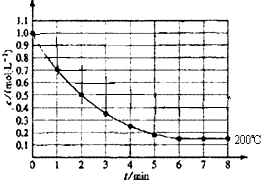
 ŌŚŅ»ĆܱÕČŻĘ÷ÖŠ·ÅČė1molX£Øg£©·¢Éś·“Ó¦£ŗX£Øg£©?4Y£Øg£©+Z£Øg£©£¬ČēĶ¼±ķŹ¾ŌŚ 200”ꏱ£¬XµÄÅضČĖꏱ¼ä±ä»ÆµÄĒśĻߣ®
ŌŚŅ»ĆܱÕČŻĘ÷ÖŠ·ÅČė1molX£Øg£©·¢Éś·“Ó¦£ŗX£Øg£©?4Y£Øg£©+Z£Øg£©£¬ČēĶ¼±ķŹ¾ŌŚ 200”ꏱ£¬XµÄÅضČĖꏱ¼ä±ä»ÆµÄĒśĻߣ®·ÖĪö £Ø1£©øł¾Żv=$\frac{”÷c}{”÷t}$½ųŠŠ¼ĘĖćĒó½ā£»
£Ø2£©ÓÉĶ¼æÉÖŖ£¬µ±6minŹ±X µÄĪļÖŹµÄĮæÅØ¶Č±£³Ö²»±ä£¬·“Ó¦“ļĘ½ŗāדĢ¬£»
£Ø3£©µŚ7minŹ±æĢ£¬“ļĘ½ŗāדĢ¬£»
£Ø4£©ŌŚ8minŹ±£¬YµÄÅضČĪŖ0.15mol/L£¬Ōņ²Ī¼Ó·“Ó¦µÄYµÄÅضČ=£Ø1.0-0.15£©mol/L=0.85mol/L£¬Ķ¬Ņ»·“Ó¦ÖŠĶ¬Ņ»Ź±¼ä¶ĪÄŚ²Ī¼Ó·“Ó¦µÄø÷ĪļÖŹµÄÅØ¶Č±ä»ÆĮæÖ®±ČµČÓŚĘä¼ĘĮæŹżÖ®±Č£¬¾Ż“Ė¼ĘĖćZÅØ¶Č£»
£Ø5£©“ļĘ½ŗāדĢ¬Ź±ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬ø÷×é·ÖµÄÅØ¶Č±£³Ö²»±ä£¬ÓÉ“Ė·ÖĪö½ā“š£®
½ā“š ½ā£ŗ£Ø1£©v£ØX£©=$\frac{”÷c}{”÷t}$=$\frac{1-0.2}{5}$=0.16mol/£ØL£®min£©£¬¶ųv£ØY£©=4v£ØX£©=4”Į0.16=0.64mol/£ØL£®min£©£¬¹Ź“š°øĪŖ£ŗ0.64mol/£ØL£®min£©£»
£Ø2£©ÓÉĶ¼æÉÖŖ£¬µ±6minŹ±X µÄĪļÖŹµÄĮæÅØ¶Č±£³Ö²»±ä£¬·“Ó¦“ļĘ½ŗāדĢ¬£¬¹Ź“š°øĪŖ£ŗ6min£»
£Ø3£©µŚ7minŹ±æĢ£¬“ļĘ½ŗāדĢ¬£¬V£ØÕż£©=V£ØÄę£©£¬¹Ź“š°øĪŖ£ŗ=£»
£Ø4£©ŌŚ8minŹ±£¬YµÄÅضČĪŖ0.15mol/L£¬Ōņ²Ī¼Ó·“Ó¦µÄYµÄÅضČ=£Ø1.0-0.15£©mol/L=0.85mol/L£¬Ķ¬Ņ»·“Ó¦ÖŠĶ¬Ņ»Ź±¼ä¶ĪÄŚ²Ī¼Ó·“Ó¦µÄø÷ĪļÖŹµÄÅØ¶Č±ä»ÆĮæÖ®±ČµČÓŚĘä¼ĘĮæŹżÖ®±Č£¬ĖłŅŌZÅØ¶Č±ä»ÆĮæ=XÅØ¶Č±ä»ÆĮæ=0.85mol/L£¬ZŹĒÉś³ÉĪļ£¬ŌņĘ½ŗāŹ±ZÅضČĪŖ0.85 mol•L-1£¬¹Ź“š°øĪŖ£ŗ0.85 mol•L-1£»
£Ø5£©a£®µ„Ī»Ź±¼äĻūŗÄ0.1molXµÄµČŠ§ÓŚÉś³É0.4molYµÄĶ¬Ź±ĻūŗÄ0.4molY£¬ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬“ļĘ½ŗāדĢ¬£¬¹ŹÕżČ·£»
b£®Ö»ŅŖ·“Ó¦·¢Éś£¬ĻąĶ¬Ź±¼äÄŚÉś³É0.1molZµÄĶ¬Ź±±ŲÓŠ0.4molYÉś³É£¬ĖłŅŌ²»Ņ»¶ØĘ½ŗā£¬¹Ź“ķĪó£»
c£®·“Ó¦ĢåĻµÖŠX”¢Y”¢ZµÄÅØ¶Č¶¼±£³Ö²»±ä£¬ĖµĆ÷ø÷ĪļÖŹµÄĮæ²»±ä·“Ó¦“ļĘ½ŗāדĢ¬£¬¹ŹÕżČ·£»
d£®»Æѧ·“Ó¦ŹĒ¶ÆĢ¬Ę½ŗā£¬Ę½ŗāŹ±ČŌŌŚ½ųŠŠ£¬¹Ź“ķĪó£»¹ŹŃ”a”¢c£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāÓŠ¹Ų¼ĘĖć”¢»ÆŃ§Ę½ŗāדĢ¬ÅŠ¶ĻµČÖŖŹ¶µć£¬ĪŖøßĘµæ¼µć£¬Ć÷Č··“Ó¦·½³ĢŹ½ÖŠø÷øöĪļĄķĮæ¹ŲĻµŹĒ½ā±¾Ģā¹Ų¼ü£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H2O | B£® | CH3OH | C£® | CS2 | D£® | CH3COOH |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 18 g H2OĖłŗ¬µÄ·Ö×ÓŹżĪŖNA | |
| B£® | 22.4 L H2OĖłŗ¬µÄ·Ö×ÓŹżĪŖNA | |
| C£® | NAøöĒāŌ×ÓµÄÖŹĮæĪŖ2 g | |
| D£® | 1 mol NaClÖŠŗ¬0.5NAøöNa+ŗĶ0.5NAøöCl- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
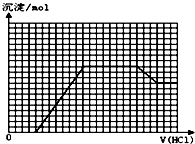 ijĪŽÉ«ČÜŅŗMæÉÄÜŗ¬ÓŠĄė×ÓOH-”¢HCO3-”¢CO32-”¢SO42-”¢SiO32-”¢AlO2-”¢NH4+”¢MnO4-”¢Cu2+”¢Mg2+”¢Na+”¢Fe3+ÖŠµÄČōøÉÖÖ£®Č”Ņ»¶ØĮæµÄMČÜŅŗµĪ¼ÓŃĪĖį£¬²śÉś³ĮµķµÄĪļÖŹµÄĮæÓėŃĪĖįĢå»żµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ØHCO3-ÓėAl3+ŗĶAlO2-¾łŅŖ·“Ó¦£¬²»¹²“ę£©£®ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ£Ø””””£©
ijĪŽÉ«ČÜŅŗMæÉÄÜŗ¬ÓŠĄė×ÓOH-”¢HCO3-”¢CO32-”¢SO42-”¢SiO32-”¢AlO2-”¢NH4+”¢MnO4-”¢Cu2+”¢Mg2+”¢Na+”¢Fe3+ÖŠµÄČōøÉÖÖ£®Č”Ņ»¶ØĮæµÄMČÜŅŗµĪ¼ÓŃĪĖį£¬²śÉś³ĮµķµÄĪļÖŹµÄĮæÓėŃĪĖįĢå»żµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ØHCO3-ÓėAl3+ŗĶAlO2-¾łŅŖ·“Ó¦£¬²»¹²“ę£©£®ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ£Ø””””£©| A£® | ŌČÜŅŗÖŠæÉÄÜŗ¬ÓŠNH4+”¢SO42- | |
| B£® | ×īÖÕČÜŅŗÖŠ×īÉŁŗ¬2ÖÖČÜÖŹ | |
| C£® | ŌČÜŅŗÖŠn£ØNaAlO2£©£ŗn£ØNa2CO3£©=1£ŗ1 | |
| D£® | µĪ¼ÓŃĪĖį³õŹ¼½×¶Ī·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ£ŗCO32-+H+ØTHCO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£®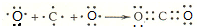 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ļņ·ŠĖ®ÖŠÖšµĪ¼ÓČėÉŁĮ汄ŗĶFeCl3ČÜŅŗ£¬æÉÖʵĆFe£ØOH£©3½ŗĢå | |
| B£® | Ć÷·ÆÄÜĖ®½āÉś³ÉAl£ØOH£©3½ŗĢ壬æÉÓĆ×÷¾»Ė®¼Į | |
| C£® | ·ŠĖ®ÖŠµĪ¼ÓŹŹĮ汄ŗĶFeCl3ČÜŅŗ£¬ŠĪ³É“ųµēµÄ½ŗĢ壬µ¼µēÄÜĮ¦ŌöĒæ | |
| D£® | ”°ŃŖŅŗĶøĪö”±ĄūÓĆĮĖ½ŗĢåµÄŠŌÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
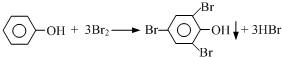
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com