
分析 (1)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物;若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0);
(2)①由电离平衡常数可知,酸性:H2CO3>HCN>HCO3-,则NaCN溶液通入少量CO2生成NaHCO3与HCN;
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,配平书写方程式;
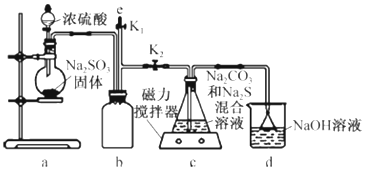
(3)a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气;
①d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成;
②二氧化硫有毒,能够与氢氧化钠反应被氢氧化钠吸收.
解答 解:(1)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,所以氯酸是氧化剂、H3PO4是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0)=20mol;
故答案为:H3PO4;20;
(2)①由电离平衡常数可知,酸性:H2CO3>HCN>HCO3-,则NaCN溶液通入少量CO2生成NaHCO3与HCN,反应方程式为:CO2+NaCN+H2O=NaHCO3+HCN,
故答案为:CO2+NaCN+H2O=NaHCO3+HCN;
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,反应方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑,
故答案为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
(3)a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气.
由仪器结构特征,可知盛装Na2SO3固体的仪器为圆底烧瓶;b装置为安全瓶,防止倒吸,
故答案为:圆底烧瓶;安全瓶,防止倒吸;
①d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成;
故答案为:Na2SO3;
②二氧化硫有毒,能够与氢氧化钠反应被氢氧化钠吸收,应用NaOH溶液吸收;
故答案为:NaOH溶液.
点评 本题为综合题,考查了氧化还原反应基本概念、氧化还原反应方程式的书写、亚硫酸钠的制备,侧重于学生的分析、实验能力的考查,题目综合性较强,熟练掌握元素化合物知识与实验制备基本原则,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
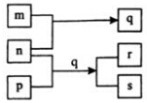 元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )
元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径的大小W<X<Z | B. | W的氧化物常温常压下为液态 | ||
| C. | Y的氧化物可能呈黑色或红棕色 | D. | Z的氧化物的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白酒 | B. | 纯碱溶液 | C. | 食盐溶液 | D. | 柠檬酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(4x-y) kJ•mol | |
| B. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(2x-y) kJ•mol-1 | |
| C. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(2y-x) kJ•mol | |
| D. | 2SO2(g)+2KOH (l)═2KHSO3 (l)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的聚沉是化学变化 | |
| B. | 含有0.01mol FeCl3的溶液制成的胶体中,胶体粒子的数目约为6.02×1021个 | |
| C. | 胶体的介稳性与胶体粒子直径大小有关 | |
| D. | NaCl晶体既可制成溶液又可制成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com