科学研究发现纳米级的Cu
2O可作为太阳光分解水的催化剂.
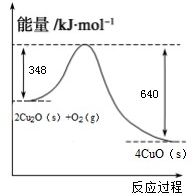
(1)火法还原CuO可制得Cu
2O.已知:
1g C(s)燃烧全部生成CO时放出热量9.2kJ;Cu
2O(s)与O
2(g)反应的能量变化如右图所示;请写出用足量炭粉还原CuO(s)制备Cu
2O(s)的热化学方程式
.
(2)在加热条件下用液态肼(N
2H
4)还原新制Cu(OH)
2可制备纳米级Cu
2O,同时生成N
2和H
2O.该反应的化学方程式为
.当生成N
2 11.2L(已换算为标准状况)时,可制备纳米级Cu
2O的质量为
.
(3)某兴趣小组同学以纳米级Cu
2O催化光解水蒸气并探究外界条件对化学平衡的影响.
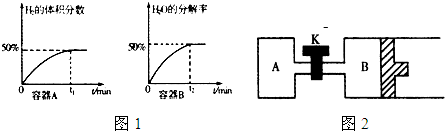
①在体积均为1L,温度分别为T
1、T
2的A、B两密闭容器中都加入纳米级Cu
2O并通人0.1mol水蒸气,发生反应:2H
2O(g)
2H
2(g)+O
2△H=484kJ?mol
-1经测定A、B两容器在反应过程中发生如图1所示变化,则A、B两容器反应的温度T
1
T
2 (填“<”、“=”或“>”),该过程中A容器至少需要吸收能量
kJ;
②当该反应处于平衡状态时,下列既能增大反应速率,又能增大H
2O(g)分解率的措施是
(填序号).
A.向平衡混合物中充入Ar B.升高反应的温度 C.增大反应体系的压强 D.向平衡混合物中充人O
2③如图2所示,当关闭K时,向容器A、B中分别充入0.2mol H
2O(g)向B中充入0.2mol H
2O(g),起始时V(A)=V(B)=1L.在相同温度(反应过程中温度保持不变,B中活塞可以自由滑动)和催化剂存在的条件下,达到平衡时,V(B)=1.2L.请回答:
A中H
2O(g)的分解率
B中H
2O的分解率.(填“<”、“=”或“>”).打开K,过一段时间重新达平衡时,B的体积为
L.(连通管中气体体积不计)

 科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.


 科学家哈迈德?译维尔研究运用激光技术观察化学反应时分子中原子的运动,在研究中证实光可诱发如图所示的变化.下列叙述不正确的是( )
科学家哈迈德?译维尔研究运用激光技术观察化学反应时分子中原子的运动,在研究中证实光可诱发如图所示的变化.下列叙述不正确的是( ) 国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.
