
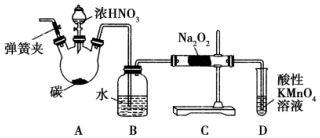
 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.分析 A装置为C与HNO3(浓)反应生成二氧化碳与二氧化氮,二氧化氮在B中与水反应是硝酸,硝酸与Cu反应生成NO,C装置中制备NaNO2,由于二氧化碳、水蒸气与过氧化钠反应的得到碳酸钠、氢氧化钠,故需要需要除去二氧化碳,并干燥NO气体,可以在B、C之间添加成分碱石灰的装置,反应开始需要排尽装置中的空气,防止氧气将NO氧化.利用酸性高锰酸钾溶液溶液氧化未反应的NO,可以防止污染空气,由题目信息,酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+.
解答 解:(1)生成的NO被O2氧化,故为防止NO被氧化,实验开始前通入一段时间气体氮气,排尽空气;
故答案为:氮气(或稀有气体);排尽空气,防止生成的NO被O2氧化;
(2)二氧化氮在B中与水反应是硝酸,硝酸与Cu反应生成硝酸铜与NO,观察到的现象为:红棕色气体消失,铜片溶解,溶液变蓝,导管口有无色气泡冒出;
故答案为:红棕色气体消失,铜片溶解,溶液变蓝,导管口有无色气泡冒出;
(3)由仪器构造可知A中盛装浓HNO3的仪器为分液漏斗;C与HNO3(浓)反应生成二氧化碳与二氧化氮,反应方程式为:C+4HNO3$\frac{\underline{\;△\;}}{\;}$CO2↑+4NO2↑+2H2O;
故答案为:分液漏斗;C+4HNO3$\frac{\underline{\;△\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)由题目信息,酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+,反应离子方程式为:3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O;
故答案为:3MnO4-+5NO+4H+═3Mn2++5NO3-+2H2O;
(5)二氧化碳、水蒸气与过氧化钠反应的得到碳酸钠、氢氧化钠,可以在B、C之间添加成分碱石灰的装置,吸收除去二氧化碳,并干燥NO气体;
故答案为:NaOH;碱石灰;
(6)n(Na2O2)=$\frac{3.12g}{78g/mol}$=0.04mol,根据2NO+Na2O2=2NaNO2知,0.04mol过氧化钠反应需要0.08molNO,设参加反应的碳为 nmol,根据C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O知,生成4nmolNO2,根据3NO2+H2O=2HNO3+NO,可知4nmolNO2与水反应生成4nmol×$\frac{2}{3}$=$\frac{8}{3}$nmol硝酸和$\frac{4}{3}$nmolNO,再根据3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,硝酸与铜反应生成的NO为$\frac{8}{3}$nmol×$\frac{2}{8}$=$\frac{2}{3}$nmol,所以$\frac{4}{3}$nmol+$\frac{2}{3}$nmol=2nmol=0.08mol,可得n=0.04mol,则需要碳的质量=12g/mol×0.04mol=0.48g;
故答案为:0.48g.
点评 本题考查物质制备实验方案的设计,涉及对原理与装置的分析评价、信息获取与迁移运用、化学计算等,(6)中计算为易错点、难点,关键是根据方程式需找B装置中得到NO与碳的物质的量关系.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Ql>Q2 | |
| B. | 反应物总能量均高于生成物总能量 | |
| C. | 1molHBr(g)具有的能量大于1molHBr(l)具有的能量 | |
| D. | 反应①生成2 molHCl(l)时放出Q1热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂瓶标签上的部分内容.现用该浓硫酸配制500mL浓度为1mol•L-1的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的硫酸试剂瓶标签上的部分内容.现用该浓硫酸配制500mL浓度为1mol•L-1的稀硫酸.可供选用的仪器有:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | 只有④ | C. | 只有③ | D. | 只有① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
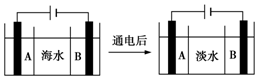 水是一种重要的自然资源,是人类赖以生存不可或缺的物质,水质优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
水是一种重要的自然资源,是人类赖以生存不可或缺的物质,水质优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6 gNa与O2完全反应,生成7g产物时失去电子的物质的量为0.2 mol | |
| B. | Na与稀硫酸反应的离子方程式为2Na+2H+=2Na++H2↑ | |
| C. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 | |
| D. | 金属钠着火可以用泡沫灭火器或用干燥的沙土灭火 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com