
【题目】下列叙述中错误的是
A. 电解池的阳极上发生氧化反应,阴极上发生还原反应
B. 原电池跟电解池连接后,电子从电池负极流向电解池阳极
C. 电镀时,电镀池里的阳极材料发生氧化反应
D. 电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
科目:高中化学 来源: 题型:
【题目】有人认为人体是一架缓慢氧化着的“高级机器”,人体在生命过程中也需要不断 地补充“燃料”。按照这种观点,你认为人们通常摄入的下列物质不能看作“燃料”的是
A. 淀粉 B. 纯净水 C. 脂肪 D. 蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
Ⅰ.硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因_____________,如何才能用热水配制出澄清的较浓的CuSO4溶液_______________;
Ⅱ.依据反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
滴定前的准备:
①→ 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
①称量绿矾样品质量为m g,配成100 mL待测溶液,②取体积为10.00mL的待测液置于锥形瓶中,并加入一定量的硫酸,③将标准浓度为1.0molL﹣1的KMnO4溶液装入滴定管中,调节液面至a mL处,④滴定待测液至滴定终点时,滴定管的液面读数b mL,⑤重复滴定2~3次。
请回答下列问题:
(1)将步骤1中的操作补充完整:
①__________________________,②__________________________
(2)KMnO4(H+)溶液应装入______式滴定管进行滴定;如何知道滴定到达终点?___________
(3)下列操作会导致测定结果偏低的是____________________
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定后滴定管尖嘴处悬有溶液未滴落
(4)实验测得FeSO4的质量分数为____________(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
反应速率最快的是
A. v(A)=0.20mol·L-1·min-1 B. v(B)=0.30 mol·L-1·min-1
C. v(C)=0.40 mol·L-1·min-1 D. v(D)=0.50 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
(1) 已知:N2(g)+2O2(g)![]() 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g)![]() O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
则N2(g)+O2(g)![]() 2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
2NO(g) △H=_________kJ/mol;汽车启动后,气缸温度越高,单位时间内NO 的排放量越大,分析其原因为_____________
(2) 若反应N2(g)+O2(g)![]() 2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
2NO(g)是在恒容条件下进行,下列能说明该反应已达到平衡状态的是________
a.2υ正(N2)= υ逆(NO) b.混合气体密度不变
c.生成1molO2的同时生成2molNO d.混合气体平均相对分子质量不变
(3) 汽车尾气净化反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若将0.20molNO和0.10molCO充入一个容积恒定为1L 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:
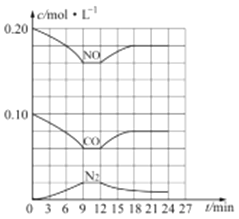
①该反应能自发进行的条件为_____ (填“高温”、“低温”或“任意温度”);
②在6~9 min 内,以CO 表示的平均反应速率 υ(CO)=________mol·L-l·min-1;
③第12min时改变的反应条件为_________ (填“升高温度”或“降低温度”);
④反应在第24min时的平衡常数K=____________(只列出计算式,无需计算结果),若保持温度不变,再向容器中充入CO、N2 各0.060mol,平衡将_________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学知识填空:
(1)丙烷通过脱氢反应可得丙烯。
已知:①C3H8(g)===CH4(g)+C2H2(g)+H2(g) ΔH1=+156.6 kJ·mol-1
②C3H6(g)===CH4(g)+C2H2(g) ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)===C3H6(g)+H2(g)的ΔH=__________kJ·mol-1。
(2)0.5mol甲烷燃烧时,生成液态水和二氧化碳,同时放出445kJ的热量,写出甲烷的燃烧热的热化学方程式_________________________________________________
(3)请写出NH4Cl溶液中各离子浓度的大小关系式:___________________________________
(4)常温下,Na2CO3溶液呈碱性,原因是_____________________ (用离子方程式表示)。
(5)①醋酸在水溶液中的电离方程式为______________________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北魏贾思勰《齐民要术·作酢法》这样描述苦酒:“乌梅苦酒法:乌梅去核,一升许肉,以五升苦酒渍数日,曝干,捣作屑。欲食,辄投水中,即成醋尔。”下列有关苦酒主要成分的说法正确的是( )
A. 苦酒的主要溶质是非电解质 B. 苦酒的主要溶质是弱电解质
C. 苦酒的主要溶质是强电解质 D. 苦酒的溶液中只存在分子,不存在离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关,下列有关说法错误的是
A. 大量燃烧化石燃料是造成雾霾天气的原因之一
B. 从海水中提取物质都必须通过化学反应才能实现
C. 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生
D. 用食醋可以除去热水壶内壁的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在________(填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是______(填序号)。
①100mL容量瓶②烧杯③滴定管夹④漏斗⑤玻璃棒⑥托盘天平
(3)到达滴定终点的标志是____________________________________________。
(4)根据上述数据计算X=________________。
(5)误差分析(填偏高、偏低或无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值________;
②若KMnO4标准溶液浓度偏低,则X值_________;
③若锥形瓶洗净后瓶内还残留有少量蒸馏水,则X值____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com